Dmitri Mendeléiev y la tabla periódica de los elementos
Beatriz S. Méndez
Departamento de Química Biológica. Facultad de Ciencias Exactas y Naturales.
Universidad de Buenos Aires. Buenos Aires. Argentina.

Obra de Iván Kramskoi
Dmitri Ivanovich Mendeléiev nació el 8 de febrero de 1834 en la entonces capital de Siberia y murió en San Petersburgo, el 2 de febrero de 1907. Miembro de una familia numerosa ya de pequeño se destacaba por su éxito en los estudios. Su madre, María Dmitrievna Mendeléieva, fue determinante en su formación. El padre quedó ciego el año de su nacimiento y en consecuencia la familia pasó a depender económicamente de la actividad de la madre como empresaria, ya que se hizo cargo de la dirección de una fábrica de productos de vidrio y elementos farmaceúticos. Cuando Dmitri terminó el bachillerato en 1849, ya muerto el padre, María Dmitrievna, consciente como nadie de la capacidad de su hijo, decidió trasladar su familia (ahora reducida a dos hijos) desde Siberia a Moscú de manera que el joven pudiese seguir una carrera universitaria. Evidentemente ambas regiones no estaban conectadas por ferrocarril y el viaje se realizó a caballo, ya fuese sobre los animales o en carruajes tirados por ellos. La universidad de Moscú solo recibía a moscovitas, y sufrió un rechazo similar en la de San Petersburgo. Sin embargo, por consejo de su madre, se inscribió en la Escuela Superior del Magisterio, dependiente de dicha universidad, en la cual cursó estudios de Física y de Matemática, el comienzo de su carrera científica.1
La trayectoria de Mendeléiev en la universidad de San Petersburgo comienza en 1857 con un cargo como docente adjunto para la enseñanza de química y finaliza en 1890 cuando se retiró con el cargo máximo de profesor. Realizó una estadía en Heidelberg en los laboratorios de Kirchhoff y de Bunsen llevando a cabo al mismo tiempo investigaciones de su autoría. Las mismas trataron sobre los fenómenos de la capilaridad a la que relacionó con la cohesión entre las moléculas y dieron lugar a publicaciones que influenciaron, aunque no fueron reconocidas como tales, los trabajos de Andrew sobre capilaridad y composición química. Durante su estadía en Heidelberg aprendió las técnicas del análisis espectral que luego aplicó en Petersburgo y le permitieron verificar posiciones de elementos en la tabla periódica. Además se relacionó con otros químicos rusos que trabajaban en Heidelberg, entre ellos Alexander Borodin.2
Su interés abarcó también el desarrollo industrial de su país, desde la divulgación científica en revistas hasta la redacción de tratados sobre tecnología. El conocimiento que tenía sobre la producción de petróleo lo llevó hasta Bakú. A partir de ese viaje escribió sobre las condiciones primitivas en las cuales se realizaba la extracción de petróleo y sugirió los métodos para revertirlas. En lo referente a la agricultura tuvo mejores logros. Desarrolló un sistema de campos experimentales en los cuales se analizó el uso, con experimentos exactos, de distintos abonos minerales llegándose a resultados sobre su mejor efecto en cuanto a composición y condiciones de aplicación.
Hay otra faceta no muy conocida de su personalidad que es su afición por el arte. Los miércoles, junto a su esposa Anna Ivánovna, se organizaban reuniones en su casa durante las cuales se trataban las novedades que tenían lugar en el arte, en especial pintura, que mucho le interesaba. Pintores como Kramskoiv, Repin, Kuindzhi y Shishkin , entre otros, eran asiduos concurrentes a esas reuniones. El conocimiento que adquirió sobre pintura y que expresó en algunos escritos, motivó su ingreso como miembro a la Academia de Bellas Artes. También, gracias a su amistad con Borodin, estaba en estrecho contacto con el grupo de compositores, entre ellos Músorgski y Rimsky –Kórsakov, que propulsaban la composición de música con características rusas.
Como profesor, además de la calidad de sus clases, sobresale la redacción de libros de texto, por ejemplo sobre Química Orgánica y Tecnología. Cuando al empezar a dictar un curso de Química en 1868 planificó la redacción de un libro de texto al que le dio el nombre de Principios de la Química. Durante la tarea de redacción se dio cuenta que: “…tenía que adoptar un cierto sistema de cuerpos simples, para no gobernarme en su distribución por motivos casuales, en cierto modo instintivo, sino por un principio exacto y determinado…”; el germen de la clasificación de los elementos por los pesos atómicos. Mendeléiev ordenó los 64 elementos conocidos por ese entonces de acuerdo a esa variable y analizando la secuencia obtenida descubrió la ley periódica, en sus palabras: “A medida que aumenta el peso atómico los elementos adquieren al principio propiedades nuevas, variables, pero que luego vuelven a repetirse en el nuevo período, en la nueva fila y serie de elementos y en el mismo orden de sucesión que en la serie precedente de ahí que la ley de periodicidad pueda ser formulada del siguiente modo: las propiedades de los elementos y en virtud de ello las propiedades de los cuerpos simples y compuestos que forman, se hallan en dependencia periódica (o sea se repiten con regularidad) de su peso atómico”.
La tabla periódica impresa en hoja suelta y con fecha 17 de febrero de 1869 la envía a todos los físicos y químicos de su conocimiento. El 18 de marzo de 1869, se la presentó en la sesión de la Sociedad Química Rusa con el título: “Experimento de un sistema de elementos basado en su peso atómico y en la afinidad química”. En el mismo año se publicó en Alemania [1]

Figura 1: Tabla enviada a la Sociedad Científica Rusa en 1869.
Además de poner en evidencia la periodicidad de las propiedades de los elementos su otra gran conclusión fue sugerir la existencia de los elementos faltantes. En 1871 dio a conocer otra tabla que presentaba 16 casillas sin llenar. Al respecto se originó un caso que tuvo características teatrales. A los elementos aún no descubiertos, pero ya con su lugar en la tabla, los designó agregando la palabra de origen sánscrito “eka”, cuyo significado es “más uno”, al nombre del análogo inmediato inferior o sea “ekaluminio” significa aluminio más uno. En 1875 el científico francés Lécoq de Boisbaudran descubrió un elemento al que llamó galio (Ga) cuya densidad era 4,7 y su peso atómico 68. Mendeléiev envió una nota a la Sociedad Fisicoquímica Rusa explicando que las propiedades del Ga coincidían con las del elemento que él denominó “ekaluminio” salvo una diferencia en la densidad que debía ser de 5,9, tal cual lo había predicho. Interesante discusión entre una teoría y una demostración experimental. Nuevas mediciones confirmaron el valor teórico encontrado por el ruso. El otro elemento “pronosticado” en la tabla, “ekaboro” fue legalizado con el descubrimiento del escandio que poseía las propiedades indicadas previamente en forma teórica. Por último el “ekasilicio” probó ser el germanio. Su descubridor el químico alemán Winkler escribió: “Es poco probable que exista una demostración más brillante en cuanto a la justeza de la teoría periódica de los elementos, ello constituye claro está, algo más que una simple confirmación de la osada teoría, es una ampliación de los horizontes de la química, un paso gigantesco en la esfera el conocimiento”. A lo largo de los años y con nuevos descubrimientos se probó que Mendeléiev había predicho 21 de los 37 elementos descubiertos con posterioridad a 1869. En la época de las primeras tablas periódicas no se conocían los gases nobles que luego fueron agregados en otra columna en 1902.
Los elementos los ordenó en la tabla periódica en función de su “peso atómico” y a la vez los caracterizó por sus propiedades físicas como, solubilidad de sus sales, punto de ebullición. Nuevos hallazgos no cambiaron significativamente la tabla pero si la comprensión de la materia. A partir del descubrimiento de las propiedades del uranio, el polonio y el radio el fenómeno de la radioactividad hizo su aparición hacia el fin del siglo XIX [2, 3,4]. Se observó que los productos de la desintegración radioactiva diferían entre sí por pequeñas variaciones en el peso atómico y posteriormente fueron llamados isótopos. Más adelante los trabajos de Rutherford, Bohr y Schrödinger indicaron que el núcleo atómico está compuesto por protones con carga positiva y neutrones y que alrededor del núcleo giran electrones con cargas negativas equivalentes y en distintas órbitas. Schrödinger consideró que los orbitales indican la probabilidad de la presencia de los electrones en una región delimitada del espacio atómico [5, 6,7].
Todos estos nuevos conceptos y sus aplicaciones fueron definiendo la forma de determinar las características y nombres de los elementos. La Unión Internacional de Química Pura y Aplicada, (IUPAC por sus siglas en inglés: International Union of Pure and Applied Chemistry) es la organización reconocida para esa actividad y responsable de la edición de la tabla. Los elementos están ordenados siguiendo el número atómico, que es el número de protones que se hallan en el núcleo y los identifica. La masa atómica corresponde al número de protones y neutrones en el núcleo. Los productos de la desintegración radioactiva difieren entre sí por pequeñas variaciones en la masa atómica originada por la diferencia en el número de neutrones, y son llamados isótopos, que se encuentran también en elementos no radioactivos. El peso atómico no es medible y, según la definición de la IUPAC, “un peso atómico (masa atómica relativa) de un elemento de una fuente especificada es la razón de la masa media por átomo del elemento respecto a 1/12 de la masa de un átomo 12C”. La definición centrada en “un” peso atómico se debe, como se señaló anteriormente, a la presencia de isótopos. Para lograr una mayor uniformidad se introdujo la unidad de masa atómica, definida como 1/12 de la masa del carbono 12. Se representa con el símbolo u; de este modo, 12C = 12u. A su vez IUPAC encarga a la Comisión sobre Abundancia de Isótopos y Pesos Atómicos (CIAAW, por sus siglas en inglés: Commission on Isotopic Abundances and Atomic Weight) la revisión bianual de los pesos atómicos de los elementos y de la presencia de isótopos. Los estándares de pesos atómicos publicados cada dos años por la CIAAW son reconocidos mundialmente y se incorporan a la tabla periódica.
Vale recordar que la estructura atómica no era conocida en los tiempos de Mendeléiev por lo que era conceptualmente adecuado considerar el peso atómico medible como la variable para ordenar la tabla. Indudablemente tenía una profunda visión de la naturaleza de los elementos químicos como lo demuestra el hecho que el ordenamiento de la tabla haya perdurado.
Los resultados de Mendeléiev fueron, en principio, recibidos con cierto resquemor por los científicos de algunos países europeos, entre otros motivos porque se consideraba a Rusia como un país de nivel cultural bajísimo. Sin embargo, para tomar un simple ejemplo, en cementerios de San Petersburgo, se hallan entre otras tumbas notables, las de Tchaikovsky, Dostoyevski, Borodin, Vera Komissarzhevskaya (actriz y empresaria teatral), Rimsky- Kórsakov, Mendeléiev y tal vez la madre de este último. ¡Vaya siglo XIX ruso!
Algo ha cambiado en estos tiempos. Las Naciones Unidas han proclamado a 2019 como el Año Internacional de la Tabla Periódica de los Elementos Químicos ya que se cumplen 150 años de la publicación del primer trabajo de Mendeléiev. La razón es que las Naciones Unidas han reconocido la importancia de la contribución de la química para la promoción del desarrollo sostenible y para proveer soluciones a los desafíos globales relacionados con la energía, la educación, la agricultura y la salud.
A su vez la IUPAC, que publica regularmente tablas periódicas actualizadas, ha ampliado la tabla en 2018 incluyendo los isótopos [8].
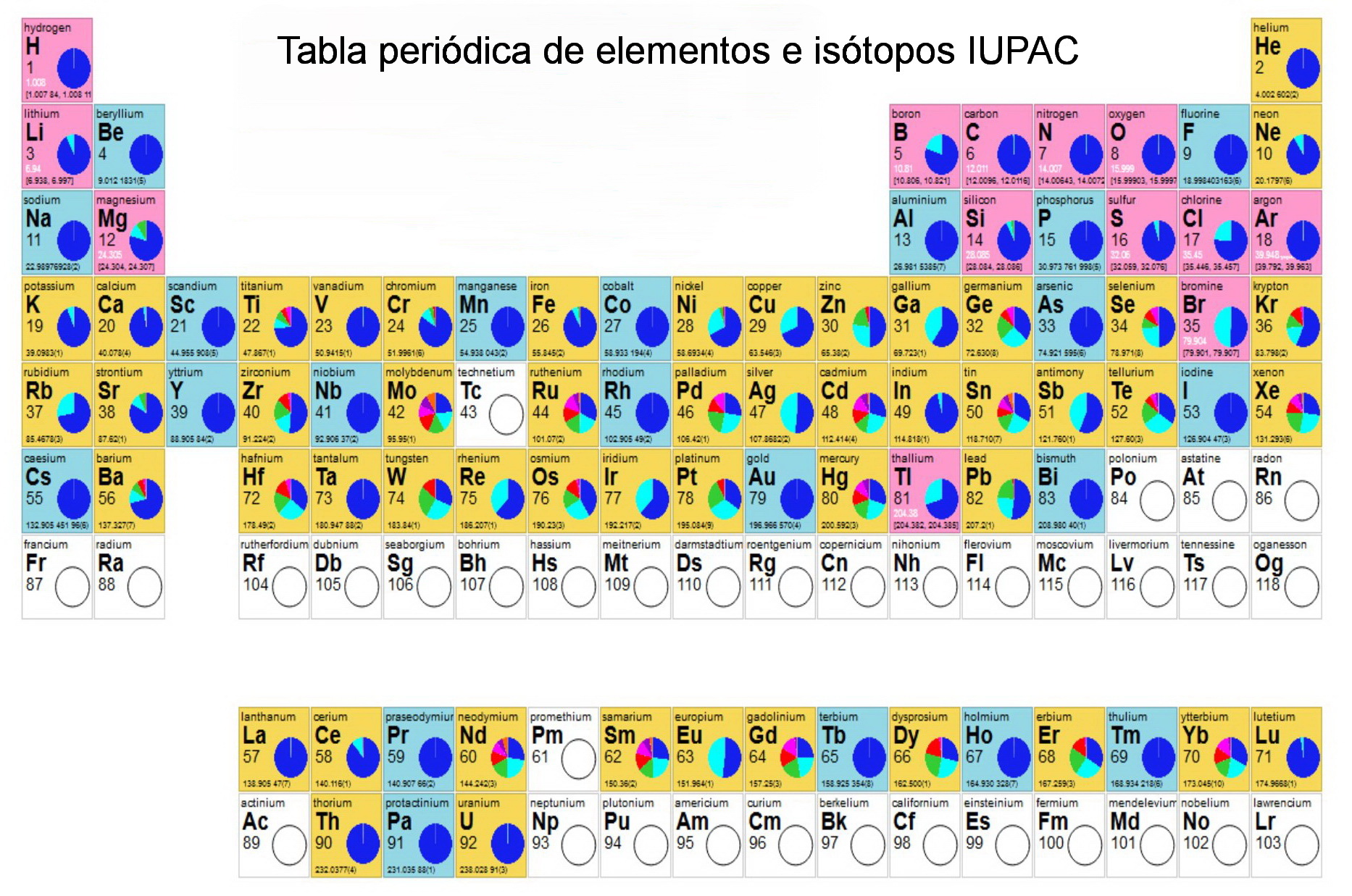
IUPAC PERIODIC TABLE of ELEMENTS and ISOTOPES. Acceda a la versión original interactiva aquí
Mendeléiev estaría feliz de ver esta tabla tan numerosa y colorida
Más recursos sobre elementos de la tabla periodica:
Tabla periódica interactiva de elementos e isótopos.
Canal Periodic Videos en YouTube
Notas al pie:
1 Dedicatoria que encabeza su estudio de las disoluciones acuosas por su peso específico: “Esta investigación está dedicada por su último hijo a la memoria de una madre. Tuvo que trabajar al frente de una fábrica para poder criarlo, le educó con el ejemplo, corrigiéndolo con el amor y, para entregárselo a la ciencia, lo sacó de Siberia, gastando los últimos recursos y las últimas fuerzas. Sus postreras disposiciones al morir fueron: huye de la suficiencia y el envanecimiento, sé tenaz en el trabajo y no en las palabras y busca pacientemente la verdad divina o científica…La última voluntad materna es sagrada para D. Mendeléiev”
2 Aunque pocos lo saben Borodin se ganaba la vida como químico, actividad en la que tenía muy buena reputación. Compartió con Mendeléiev la estadía en Heidelberg, durante la cual trabajó en el laboratorio de Emil Erlenmeyer sobre derivados del benceno. http://pubs.acs.org/doi/pdfplus/10.1021/ed083p561. En la foto, empezando de la derecha, Borodin es el segundo y Mendeléiev el tercero

Fotografía realizada en Heidelberg (hacia 1860)
Referencias:
General
Pisarzhevski ON (1955) Dimitri Ivanovich Mendeléiev. Su vida y su obra. Moscú: Ediciones En Lenguas Extranjeras
Específicas
1. Mendelejew D (1869) Über die beziehungen der eigenschaften zu den atomgewichten der element. Zeitschrift für Chemie: 405-406
2. Becquerel AH (1896). Émission de radiations nouvelles par l'uranium métallique. Comptes Rendus de l'Académie des Sciences 122: 1086-1088
3. Curie M (1898) Rayons émit par composés d'uranium et du thorium. Comptes Rendus de l'Académie des Sciences 126: 1101-1103
4. Curie M, Curie P (1898) Sur une substance nouvelle radioactive contenue dans la pechblende. Comptes Rendus de l'Académie des Sciences 127: 175-178.
5. Rutherford, E (1911) The scattering of alpha and beta particles by matter and the structure of the atom. Philosophical Magazine. 21: 669.
6. Bohr, N (1913) On the constitution of atoms and molecules, parts I, II and III. doi:10.1080/1478644130863495 ; doi:10.1080/14786441308634993 ; doi:10.1080/14786441308635031
7. Schrödinger, E (1926). An Undulatory Theory of the Mechanics of Atoms and Molecules. Physical Reviews 28 (6): 1049-1070.
8. IUPAC (2018) Periodic table of the elements and isotopes. https://www.isotopesmatter.com/applets/IPTEI/IPTEI.html
|
Revista QuímicaViva Número 1, año 18, Abril 2019 quimicaviva@qb.fcen.uba.ar |