Omega 3: el eslabón perdido de una dieta saludable
Sabrina Sol Bockor, Mateo Nicolás Díaz Appella, Tania Belén Gordillo, Miranda Clara Palumbo, María Mercedes Palomino, Sandra Mónica Ruzal, Mariana Claudia Allievi
Departamento de Química Biológica, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires - Instituto de Química Biológica de la Facultad de Ciencias Exactas y Naturales (IQUIBICEN) - CONICET, Ciudad Universitaria, CABA, C1428EGA, Argentina
Resumen
Los ácidos grasos poliinsaturados omega 3 son nutrientes esenciales para la gran mayoría de los vertebrados. Dos de estos compuestos de gran relevancia son el ácido eicosapentaenoico (EPA) y el ácido docosahexaenoico (DHA), sintetizados principalmente a nivel marino por microalgas, que alcanzan al ser humano a través del consumo de peces que los acumulan. La marcada disminución en su consumo post revolución agrícola ha sido asociada a numerosas patologías. En este sentido, la relación en el consumo de omega 3 y de otro compuesto estructuralmente relacionado, el omega 6, pareciera jugar un rol clave en los efectos de estos ácidos grasos en nuestro organismo. Particularmente, altos consumos de omega 3 han sido correlacionados con una menor incidencia de patologías cardiacas, en un mejor desarrollo neuronal fetal y desempeño de capacidades cognitivas de adultos mayores, entre otros. Dada su importancia, resulta fundamental encontrar estrategias para incorporarlos como parte de la actual dieta occidental de forma sana y equilibrada. En este artículo se abordarán los principales efectos sobre la salud de los ácidos grasos poliinsaturados y los desafíos para su incorporación en los alimentos.
Palabras clave: Ácidos grasos poliinsaturados, Omega 3, EPA, DHA
Omega 3: the missing link of a healthy diet
Summary
Omega-3 polyunsaturated fatty acids are essential nutrients for the vast majority of vertebrates. Two of these highly relevant compounds are eicosapentaenoic acid (EPA) and docosahexaenoic acid (DHA). Both are mainly synthesized by microalgae and reach humans through the consumption of fish that accumulate such fatty acids. The significant decrease in its consumption after the agricultural revolution has been associated with several pathologies. The ratio between the consumptions of omega-3 and another structurally related compound, omega-6, seems to play a key role in the effects of these fatty acids in our body. In particular, high intakes of omega-3 have been correlated with a lower incidence rate of cardiac pathologies, more optimal fetal neuronal development and performance of cognitive abilities in elderly adults, among others benefits. In view of their importance, it is essential to develop new strategies in order to include them as part of the current Western diet in a healthy and well-balanced way. This article will address the main health effects of polyunsaturated fatty acids and the challenges of incorporating them into food.
Keywords: Polyunsaturated fatty acids, Omega 3, DHA, EPA
Introducción
Desde la era pre-agrícola hasta hoy, a través de miles de años, la importancia en la dieta de los ácidos grasos poliinsaturados omega 3 ha variado. En aquella época, la dieta estaba basada en los alimentos disponibles: la carne magra, el pescado, los vegetales de hojas verdes, frutas y frutos secos. Esta alimentación fue la que determinó los requerimientos nutricionales genéticos del humano moderno. A pesar del paso del tiempo, nuestros genes no sufrieron grandes modificaciones desde el período paleolítico (¡40000 años atrás!); sin embargo, nuestras dietas han variado considerablemente [1][2].
Uno de los mayores cambios en nuestra alimentación fue dado por la incorporación de cereales con la llegada de la Revolución Agrícola. Los cereales se convirtieron en la base de nuestra dieta pero, teniendo en cuenta la extensa y completa historia del ser humano, esta transformación ocurrió en un corto período de tiempo y representó un cambio brusco frente a la dieta a la cual estamos genéticamente adaptados. Los cereales presentan un alto contenido de carbohidratos y ácidos grasos omega 6 pero un bajo contenido de omega 3 y antioxidantes [1]. Con el transcurso de la historia, el contenido de ácidos grasos omega 3 en nuestra dieta fue disminuyendo.
A estos cambios estructurales en la dieta, se agregan nuevos hábitos de la sociedad moderna, inclinada a un consumo de productos procesados, un aumento en el consumo de grasas saturadas, de ácidos grasos trans y de aceites vegetales ricos en omega 6 acompañados de un consumo disminuido de alimentos frescos. Desde el punto de vista genético, actualmente vivimos en un entorno nutricional que difiere de aquel para el que se seleccionó nuestra constitución genética [1] y donde el omega 3 tenía un protagonismo mucho mayor.
En este contexto, numerosos estudios han reportado que el desbalance en la ingesta de los ácidos grasos esenciales omega 6 y omega 3 está asociado a problemas de salud modernos y que la incorporación de ácidos grasos omega 3 estaría vinculado con una disminución en el riesgo de padecer diversas patologías en todas las categorías etarias, tales como enfermedades cardíacas, inmunológicas y enfermedades infecciosas, entre muchas otras.
La química detrás de los ácidos grasos: al encuentro de lo esencial
Para entender la importancia de los ácidos grasos omega 3 en la dieta es necesario definirlos. En primer lugar, los ácidos grasos (AG) son ácidos monocarboxílicos de cadena larga que generalmente contienen un número par de átomos de carbono, normalmente entre 8 y 22. En una primera clasificación, los AG pueden dividirse en dos grandes grupos: los AG saturados y los AG insaturados. Dependiendo del grado de insaturación, éstos últimos pueden clasificarse a su vez en AG monoinsaturados (aquellos que presentan un único enlace doble) y en AG poliinsaturados, también denominados PUFAs (por sus siglas en inglés: poly-unsaturated fatty acids). Los PUFAs incluyen las series de los ácidos grasos omega 3 y omega 6. Las dos familias se diferencian por la posición del primer doble enlace, contando a partir del extremo metilo de la molécula (figura 1). Cuando el primer doble enlace se encuentra en el carbono tres respecto del extremo metilo, los AG pertenecen a la familia de los omega 3; cuando la primera insaturación se presenta en el carbono 6 respecto del C metilo, esta familia corresponde a los omega 6.
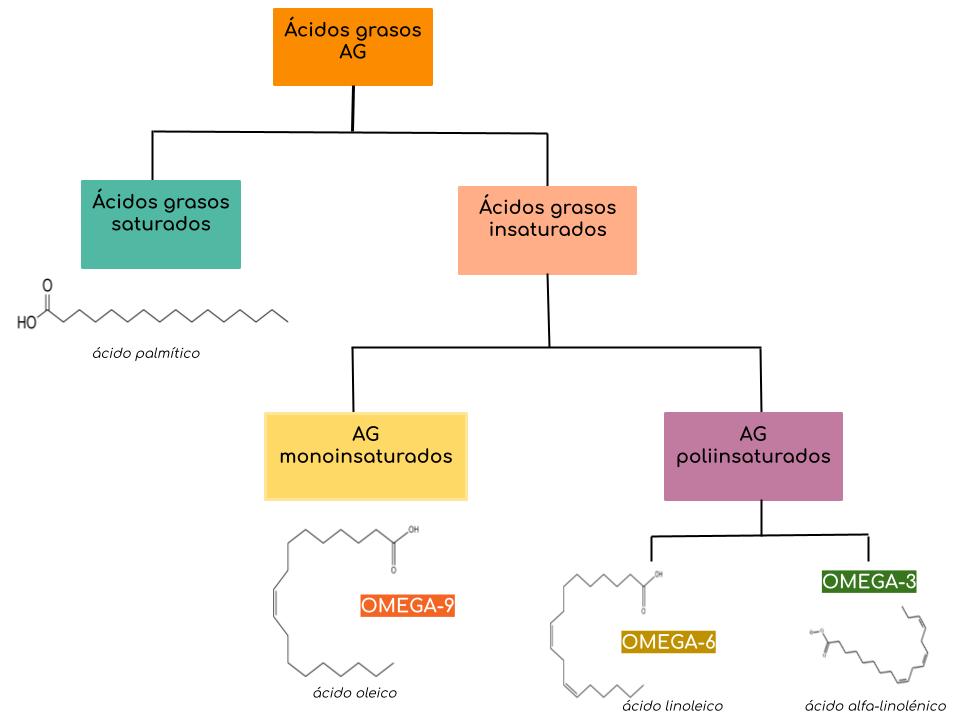
Figura 1: Clasificación de ácidos grasos según el grado de insaturación.
Los ácidos grasos omega 6 están representados por el ácido linoleico (LA, 18:2ω-6) y los omega 3, por el ácido alfa linolénico (ALA, 18:3ω-3). Como nuestro organismo carece de las enzimas necesarias para insertar insaturaciones en los átomos de carbono que están más allá del carbono 9 a partir del carboxilo terminal, tanto los omega 6 como los omega 3 deben ser ingeridos en la dieta, considerándose AG esenciales [3].
Los ácidos grasos omega 3 pueden encontrarse en tres principales formas: alfa linolénico (18:3 omega 3, a-ALA), ácido eicosapentaenoico (20:5 omega 3, EPA), y ácido docosahexaenoico (22:6 omega 3, DHA) (figura 2). En la naturaleza, los omega 3 existen principalmente en su forma esterificada asociados a los fosfolípidos de la membrana celular o en su forma de triglicéridos en lípidos de almacenamiento [4].
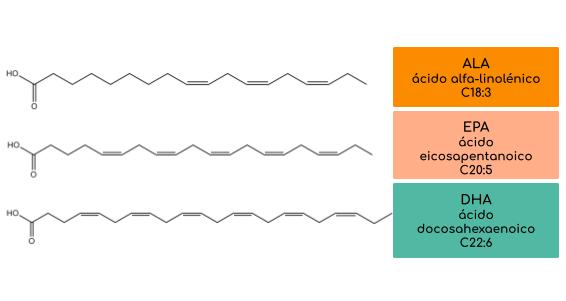
Figura 2: Principales formas de los ácidos grasos omega-3.
El EPA y el DHA se pueden sintetizar en el cuerpo humano utilizando ALA como precursor mediante la acción enzimática de desaturasas y elongasas, pero la tasa de conversión es baja, en promedio de 4-14% para hombres y mujeres, respectivamente [5]. El DHA y el EPA también pueden interconvertirse, con una eficiencia extremadamente baja, igual al 0,1% [6]. Teniendo en cuenta que son ácidos grasos esenciales y que debemos ingerirlos en la dieta, estas cifras muestran la importancia de incorporar todas las formas de omega 3, no solo ALA, sino EPA y DHA, siendo en particular estos últimos los que ejercen un mayor efecto en la salud.
Omega 3 en la dieta: Fuentes
Para tener una dieta variada rica en omega 3 resulta apropiada la inclusión tanto de fuentes vegetales como marinas. La fuente principal del ácido linolénico (ALA) son los vegetales: semillas, frutos secos y algunos aceites como el de lino, chía, nuez y soja [7,8]. El EPA y el DHA se encuentran mayoritariamente en fuentes marinas como el pescado azul graso [7] y en microalgas, que son los productores predominantes de omega 3 en la biosfera [9]. El EPA y DHA son sintetizados por el fitoplancton, se transfieren a través de la cadena alimentaria y se depositan en los lípidos de peces y mamíferos marinos [4]. Principalmente, se almacenan en el hígado de pescados blancos magros como el bacalao, en el cuerpo de pescados grasos como la caballa y el salmón, y en la grasa de mamíferos marinos como las focas y las ballenas [10]. También existen invertebrados marinos que tienen la habilidad de sintetizar alguno de dichos ácidos grasos de novo [11]. Resulta interesante notar que el consumo de omega 3 está estrechamente ligado al consumo de pescado dado que es la principal fuente de DHA y EPA para humanos [12]. Sin embargo, se ha alertado sobre el alto contenido de sustancias nocivas como el metil mercurio, que también incorporan los peces, que pueden tener efectos neurotóxicos en el desarrollo del sistema nervioso central del feto [13]. Más aún, en el caso particular de EPA/DHA, existen factores de costo y preferencias culturales que limitan el consumo de pescado de mar u otras fuentes ricas en estos micronutrientes. En consecuencia, el interés actual es plantear nuevas estrategias para el consumo de estos AG benéficos para la salud. Una de las formas potenciales de paliar la carencia de ácidos grasos omega 3 es el desarrollo de estrategias para fortificar alimentos con omega 3 de manera óptima y eficiente.
Omega 3 vs Omega 6: en busca del equilibrio
La incorporación de los cereales como una de las bases de la alimentación aumentó el consumo relativo de omega 6. Pero esto no incluye todos los cambios en la dieta que surgieron desde entonces. En los últimos 150 años, el predominio de productos industrializados y ultra procesados ricos en ácidos grasos saturados, el desarrollo de la industria de los aceites vegetales con alto contenido de omega 6 y la aplicación de técnicas de agricultura moderna como la alimentación para el ganado a base de granos, logró extender la brecha en el consumo de los AG esenciales, aumentando excesivamente el consumo de omega 6 y disminuyendo el de omega 3 [1,2] [14]. El desbalance, presente sobre todo en las dietas occidentales, promueve la patogénesis de múltiples enfermedades, incluyendo enfermedades cardiovasculares, cáncer, procesos inflamatorios y autoinmunes [15]. Estos problemas surgen debido a que nuestra constitución genética no está adaptada a la ausencia de omega 3 en la dieta, como fue mencionado previamente. Fuentes bibliográficas sugieren que los humanos evolucionaron con una dieta cuya relación de ácidos grasos omega 3/omega 6 era aproximadamente 1 [14]. Sin embargo, en estos últimos años, se encuentran relaciones mayores a 1:10 (incluso 1:25-1:50 con el consumo regular de comida rápida, altas ingesta de frituras y baja de alimentos frescos) que son desaconsejadas [16]. Es así como el cociente omega 3/omega 6 se ha convertido en un modelo para medir el equilibrio adecuado de estos ácidos grasos en aceites y en la dieta [17].
Pero ¿cuáles son las razones fisiológicas detrás de este requisito en nuestros organismos? La respuesta se encuentra en el metabolismo de estos AG una vez que son incorporados por la dieta. Al igual que el ácido linolénico (ALA), que se metaboliza para obtener ácidos grasos de cadena larga como EPA y DHA dentro del organismo, el ácido linoléico (LA, omega 6) también sufre este tipo de reacciones dando lugar, entre otros metabolitos, al ácido araquidónico (AA) (figura 3).
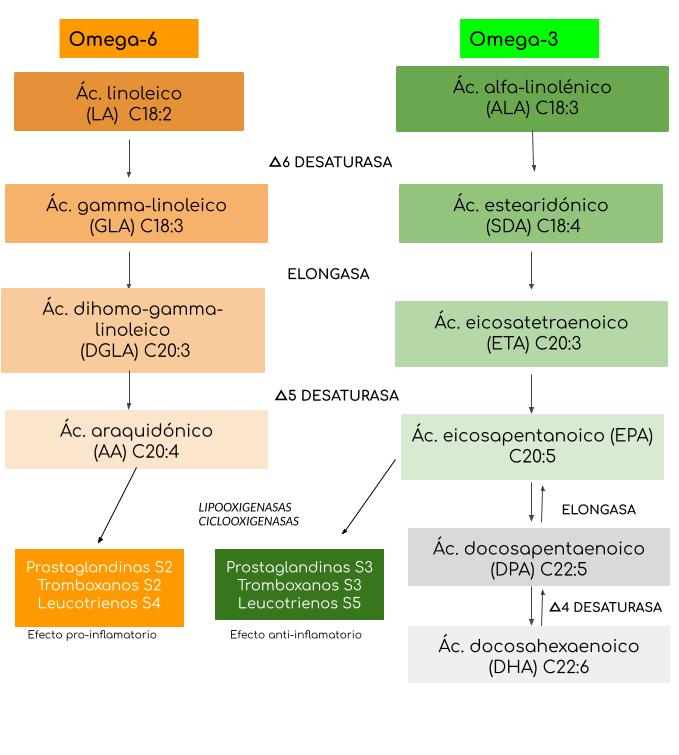
Figura 3: Biosíntesis de los principales ácidos grasos poliinsaturados esenciales y algunos de sus metabolitos característicos.
ALA, LA y sus derivados de cadena larga son componentes importantes en las membranas celulares, y a su vez son metabólica y funcionalmente distintos: con frecuencia presentan funciones fisiológicas importantes y opuestas [15].
Tanto el ácido araquidónico (AA) como el ácido eicosapentanoico (EPA) son los precursores de una serie de compuestos denominados eicosanoides, cuyo origen está dado por la oxidación de dichos ácidos grasos [18]. Entre estos compuestos se encuentran prostaglandinas, prostaciclinas, tromboxanos, leucotrienos y lipoxinas, los cuales están involucrados en diversas acciones fisiológicas [19][7]. Los eicosanoides derivados de omega 6 y de omega 3 presentan funciones muy distintas. Los eicosanoides derivados de AA están asociados con una acción proinflamatoria y proagregatoria, y también actúan como vasoconstrictores [7]. Son biológicamente activos en bajas cantidades pero pueden contribuir a la formación de ateromas, trombos o desórdenes inflamatorios y alérgicos, especialmente en individuos susceptibles, si se producen en cantidades mayores [15]. Por otro lado, los compuestos derivados de EPA son menos activos y están asociados a un efecto antiinflamatorio, actuando como vasodilatadores y antiagregantes; es decir, pueden parcialmente oponerse o antagonizar la acción proinflamatoria de los eicosanoides derivados de AA, manteniéndose un equilibrio entre ellos [15] [18].
Se pueden nombrar varios mecanismos a partir de los cuales el consumo balanceado de los ácidos esenciales modula los efectos inflamatorios en el cuerpo. Uno de ellos se basa en la existencia de una competencia entre los ácidos grasos omega 6 y omega 3 por las enzimas de desaturación que permiten la generación de AA, EPA y DHA [4]. Aunque estas enzimas presentan una mayor afinidad por ALA que LA, una alta ingesta de LA interfiere con la desaturación y elongación del ácido linolénico [20,21]. Se ha demostrado que con sólo reducir el consumo de omega 6 aumenta la concentración de AG omega 3 en plasma [22]. Además, también ocurre una competencia entre ambos ácidos grasos en la formación de eicosanoides. EPA compite con AA a nivel de las enzimas ciclooxigenasa y lipooxigenasa por la producción de prostaglandinas y leucotrienos [23].
Cuando se incorpora EPA y DHA al organismo, se reemplazan parcialmente los ácidos grasos omega 6, especialmente AA, de las membranas de las células, especialmente en las membranas de plaquetas, eritrocitos, neutrófilos, monocitos y células del hígado, produciéndose un desplazamiento del omega 6 de los tejidos y modulando de esta forma, la producción de sus metabolitos inflamatorios [23,24].
De esta manera, una dieta excesivamente rica en omega 6 frente al consumo pobre de omega 3 cambia el estado fisiológico a uno protrombótico, proagregatorio y proinflamatorio, contribuyendo a un estado donde se podría favorecer la prevalencia de distintas patologías [15]. El balance, entonces, de los ácidos grasos esenciales resulta fundamental para una buena salud y un desarrollo normal.
Omega 3 en la salud
Los ácidos grasos omega 3 y sus beneficios en la salud son objeto de estudio desde hace algunas décadas. El primer estudio que dio relevancia a su consumo se realizó en los años cincuenta en una población nativa de Alaska [25]. En 1976, reportaron que, en estos nativos, su dieta alta en AG omega 3 estaba relacionada con una menor incidencia de enfermedades del corazón [26]. Desde ese entonces, nuevos hallazgos y reportes apoyaron o contradijeron estos resultados, pero marcaron las bases para el estudio exhaustivo de los efectos, las dosis y los mecanismos por los cuales estos ácidos grasos podrían brindar beneficios a la salud y prevenir enfermedades.
Actualmente, el mayor efecto que se le atribuye al consumo de ácidos grasos omega 3 es el efecto protector frente a enfermedades cardiovasculares. Estudios basados en ensayos clínicos mostraron que el consumo de omega 3 podría proveer un beneficio de supervivencia frente a la enfermedad cardiovascular, previniendo muertes cardíacas repentinas [27] y mejorando los resultados de fallas cardíacas.[28]. Algunos ensayos clínicos utilizando como única intervención el consumo de pescado de mar o su aceite (aportando ~900 mg de EPA+DHA) parecen sugerir una reducción de un ~33% la mortalidad por enfermedad cardíaca y un 21-30% la mortalidad total [27][29]. A su vez, se ha demostrado que el consumo de aceites ricos en DHA mejora parámetros como colesterol, triglicéridos y presión sanguínea [29,30].
Recientemente, se ha encontrado evidencia de una posible correlación entre los valores de EPA+DHA y la recuperación de la frecuencia cardíaca en hombres y mujeres saludables que se sometieron a exámenes clínicos por un período de diez años [31]. Se encontró que al aumentar el índice de omega 3, la frecuencia cardíaca desciende con mayor rapidez luego de un esfuerzo máximo. Dado que estudios anteriores han demostrado que una recuperación lenta de la frecuencia cardíaca está asociada con un mayor riesgo de muerte cardíaca súbita, estos resultados parecen sugerir un potencial mecanismo cardioprotector de estos ácidos grasos poliinsaturados [32].
Los efectos del consumo de estos ácidos grasos se hacen particularmente visibles en la población con menor consumo de omega 3 previo y la mayor protección se observa en personas que ya tenían enfermedades coronarias existentes. En todos los casos, se afirma la importancia de la dosis que juega un rol fundamental en los efectos, así como la forma del omega 3 que afecta su biodisponibilidad, la población estudiada y los hábitos dietarios respecto a su consumo [33].
Se han propuesto múltiples mecanismos moleculares para explicar el efecto cardioprotector de los ácidos grasos omega 3 en el organismo, en particular DHA y EPA. Además de la producción de eicosanoides que antagonizan parcialmente efectos proinflamatorios de metabolitos derivados de AA, se pueden mencionar otras vías de acción. Por un lado, la incorporación de los AG omega 3 en el organismo y, especialmente, en las membranas puede desencadenar cambios importantes en sus propiedades y consecuentemente, podría modificar la funcionalidad y localización de proteínas transmembrana como receptores y la forma en la que los ligandos interactúan entre ellos. De esta forma, se sugiere que los AG omega 3 pueden estar involucrados en la regulación de vías de señalización celular que regulan factores transcripcionales [34] y en la función de los canales iónicos (con un efecto particular antiarrítmico) [35]. Por otro lado, estos ácidos juegan un rol fundamental en la regulación de genes críticos para el control de la homeostasis lipídica [35]. Muchas fuentes sugieren que los ácidos grasos omega 3 y sus metabolitos reducen la producción de triacilglicerol
ya sea mediante la disminución del ensamblaje y secreción de lipoproteínas de baja densidad como mediante la promoción de la beta oxidación de AG al unirse a receptores que actúan como factores de transcripción y regulan la expresión de genes (receptores PPAR) [36]. Diversos estudios sugieren que los AG omega 3 modifican la función endotelial y que aumentan la relajación dependiente del endotelio aumentando la liberación de óxido nítrico y favoreciendo la vasodilatación [37,38]. Además, el consumo de EPA y DHA podría ejercer un efecto coronario positivo al mejorar la función mitocondrial y la eficiencia en la generación de ATP gracias a posibles cambios en la composición de fosfolípidos de la membrana mitocondrial [39].En cuanto a sus efectos benéficos en otros tejidos, se ha encontrado en el sistema nervioso que el aumento de los AG omega 3 en las membranas tiene importantes repercusiones en funciones cerebrales tanto durante la gestación como en etapas tempranas del desarrollo. Esto se debe a que el DHA se puede encontrar en membranas del cerebro y retina [40] y es importante para el desarrollo fetal. Niños de madres que fueron suplementadas con omega 3 durante el embarazo, presentaron mayor coordinación y memoria comparados con niños de madres sin suplementar ante pruebas de habilidades cognitivas [41]. También se ha reportado que la suplementación durante el embarazo con DHA asiste en la maduración del sistema visual del feto [42]. A su vez, hay evidencia de que la ingesta durante el embarazo de estos ácidos influye en mejorar el peso del infante al nacer y la duración de la gestación [4] y se ha sugerido un efecto potencial en las enfermedades alérgicas [43,44]. Sin embargo, se requiere evidencia más contundente de sus efectos particulares y las dosis requeridas, aunque hay recomendaciones específicas para gestantes sobre el consumo de pescado [33].v
En este contexto asociado al sistema nervioso, hay estudios recientes sobre una potencial influencia en la capacidad cognitiva de adultos mayores [45]. Por otro lado, estudios epidemiológicos han mostrado que el consumo de pescado estaría asociado a un bajo riesgo de depresión, una disminución en los síntomas y que el aceite de pescado tendría un efecto protector en jóvenes de hasta 25 años respecto a desórdenes depresivos graves [46,47].
Los mecanismos de acción propuestos de los PUFAs en la función cerebral parten de la premisa que el DHA es un componente principal de los fosfolípidos de membrana de este órgano. Algunos de estos mecanismos incluyen modificaciones en la fluidez de la membrana, el número y la afinidad de receptores, la función de los canales iónicos, la producción y actividad de neurotransmisores y la transducción de señales [48].
En los últimos años, el estudio de la microbiota ha ganado importancia debido a que la interacción microbiota-hospedador resulta central en múltiples procesos que sufre nuestro organismo desde el comienzo de la vida. Sin embargo, el impacto del consumo de omega 3 en la microbiota intestinal aún no está completamente definido. Algunos estudios hechos en humanos mostraron cambios comunes en la microbiota luego de la suplementación con omega 3 PUFAs que podrían tener una acción positiva revirtiendo la composición de la microbiota en pacientes con enfermedad inflamatoria intestinal, además de su posible influencia en el eje intestino-cerebro [49]. A pesar de estos resultados motivadores, aún hay mucho por entender de esta compleja interacción.
En el contexto mundial actual dado por la pandemia causada por SARS-CoV-2, y aprovechando el efecto antiinflamatorio de los ácidos grasos omega 3, se está llevando a cabo el estudio PREPARE-IT en Argentina [50]. Este ensayo postula que la administración de un éster etílico de EPA podría reducir el contagio en sujetos con alto riesgo de infectarse con SARS-CoV-2 y reducir las complicaciones clínicas relacionadas con COVID-19 para la población expuesta, en particular, trabajadores de la salud.
Omega 3 en la dieta: Perspectivas
Previo al año 2002, sólo existían recomendaciones oficiales para la ingesta de ALA (1100-1600 mg/día). Sin embargo, en vista de los avances científicos, actualmente se recomienda también la ingesta de EPA+DHA (250-500 mg/día) con fines preventivos [51,52], mientras que la American Heart Association (AHA) recomienda 1000 mg/día de EPA+DHA para prevención secundaria de enfermedades cardiovasculares [51]. Esto significa que los niveles de EPA+DHA totales en la dieta corriente deberían incrementarse unas 5-15 veces [53].
En cuanto a la relación omega 3/omega 6 aún no hay un consenso claro sobre qué relación de consumo sería preferible. Actualmente, es de gran interés estudiar si una relación específica de consumo de estos ácidos grasos esenciales podría ejercer ciertos beneficios a la salud del consumidor para problemas particulares, como se postuló el efecto de la relación 1:4 en el funcionamiento del sistema nervioso [15][54]. Muchos investigadores han sugerido que, de todas formas, la relación omega 3/omega 6 no debería superar la relación 1:10 [55][15].
Debido al contenido de sustancias nocivas que pueden contener las fuentes marinas, y la dificultad de incorporar pescado en la dieta occidental por factores culturales, es de interés actual plantear nuevas estrategias para el consumo de estos ácidos grasos benéficos para la salud. Los ácidos grasos omega 3 se presentan en muchos suplementos dietarios, incluyendo el aceite de pescado, de krill, y algunos aceites provenientes de algas. Uno de los grandes problemas que conllevan es su susceptibilidad a la oxidación y a desarrollar deterioro organoléptico [56]. Una alternativa es el consumo de cápsulas blandas de aceite de pescado. En estos productos se suele contener entre 500 mg a 1000 mg de aceite, aportando en promedio de 250 a 300 mg de EPA+DHA [57].
Muchos autores destacan que el consumo de alimentos ricos en ácidos grasos omega 3 presentan un efecto benéfico mayor al de otros suplementos dietarios como aceites. Sugieren la existencia de un efecto de matriz dado por el contenido de lípidos del alimento que incrementa la biodisponibilidad de los ácidos. Dichos estudios recomiendan el consumo de formulaciones con omega 3 y alimentos con alto contenido de grasa [58,59]. Sin embargo, las personas con alto riesgo cardiovascular no deberían consumir alimentos ricos en lípidos. Frente a este problema, se proponen métodos que se basan en la emulsificación de los aceites que permite una biodisponibilidad alta independientemente de la matriz en la que se encuentren [59].
Las alternativas más recientes incluyen la micro y nanoencapsulación que se basan en la dispersión del aceite y su atrapamiento en polímeros de maltodextrina, derivados de almidón o celulósicos preparando micro o nanopartículas conteniendo aceite. Se trata de un producto que puede adicionarse en distintos alimentos en base seca o en base líquida que aumenten la funcionalidad del alimento y aporten estabilidad al aceite [57].
Uno de los grandes desafíos para la incorporación de los omega 3 en los alimentos es prevenir su oxidación. Por ello, todo el procesamiento del alimento debe ocurrir evitando la oxigenación, la luz UV, la humedad, los iones metálicos y sobre todo en frío. Los alimentos conteniendo omega 3 para ejercer el efecto benéfico deben ser consumidos con frecuencia, almacenados a bajas temperaturas y en recipientes con poco intercambio de oxígeno en envases bien impermeables. Todas estas características se asemejan a las condiciones de los alimentos lácteos, y más específicamente a los yogures: productos lácteos fermentados cuya vida útil es relativamente corta, con requerimientos de cadena de frío y que tienen una matriz más anaeróbica que la leche y más resistente a la oxidación. Por esta razón se los incluyó como una nueva plataforma para vehiculizar omega 3.
Actualmente, existen en el mercado productos lácteos como leche y yogur fortificados con ácidos grasos omega-3 provenientes de semillas de lino, aceite de pescado o microalgas marinas. La fortificación se realiza tanto por adición directa de aceite o manipulando la dieta de los rumiantes para incrementar el contenido de omega-3 en la leche producida en la glándula mamaria. Lamentablemente, este último abordaje sólo aumenta modestamente (menos del 4%) la concentración de EPA y DHA en leche [60]. Por ello, resulta fundamental lograr adicionarlo de forma eficiente y óptima mediante su emulsificación.
¿Es posible incluir bacterias ácido lácticas (presentes en el desarrollo y procesamiento del yogur) y PUFAs en un alimento manteniendo propiedades? Si quisiéramos incluirlas deberíamos en primer lugar evaluar su supervivencia. Kankaanpää y colaboradores (2001) observaron que en algunas especies del género Lacticaseibacillus con las que trabajaron, el agregado de estos AG no afectó su viabilidad [61]. Lo que resultó sorprendente fue que los PUFAs cambiaron sitios de adhesión de las bacterias ácido lácticas por modificaciones en la composición de la membrana celular, mostrando una correlación entre variantes de PUFAs y la adhesión a líneas celulares del epitelio intestinal. Es decir, la inclusión de estos AG en un alimento modificó la adhesión bacteriana, propiedad necesaria para ejercer los beneficios de los microorganismos probióticos [62].
Para mejorar la estabilidad oxidativa en el contexto del alimento conteniendo microorganismos, se ha trabajado tanto en la utilización de emulsiones como en la microencapsulación. Eratte y colaboradores (2016) han conseguido co-microencapsular Lacticaseibacillus casei y omega 3 en goma arábiga y aislado de proteína de suero de leche (WPI) [63]. En este caso, hubo una sinergia entre la estabilidad oxidativa del aceite omega-3 y la viabilidad de las bacterias probióticas al co-microencapsular.
Otros científicos se enfocaron en incorporar en el alimento microalgas como fuente de omega 3, teniendo en cuenta el impacto en los parámetros sensoriales, necesarios para la aceptación de un alimento. Pese a que lograron desde un punto de vista tecno-funcional incorporar altas concentraciones del aceite de microalgas, el producto final no fue bien aceptado por el panel de análisis sensorial. La mejor opción que plantean los investigadores fue la microencapsulación, que evita tanto la oxidación (causante del aroma desagradable) como el gusto a pescado [64].
Así es que, teniendo en cuenta los proyectos de incorporar PUFAs en el alimento, surgen enormes desafíos para incluir bacterias lácticas y omega 3. En primer lugar, utilizar dosis de omega 3 que se acerquen a las preventivas; en segundo lugar, que la adición del AG no afecte negativamente la sobrevida ni las propiedades de adhesión de los lactobacilos; pero además, que las características sensoriales sean aptas para los consumidores. En este último punto, surgen como mejores estrategias la microencapsulación y la emulsificación.
En conclusión, los ácidos grasos omega 3 han sido desplazados de nuestras dietas por muchos años y a pesar de que aún hace falta profundizar en la investigación y en las pruebas clínicas para asegurar todos sus efectos particulares en la salud, es indudable la necesidad de incorporarlos como parte de una dieta sana y equilibrada. A partir de esta premisa surgen muchos desafíos: alentar el consumo de alimentos ricos en omega 3, desarrollar nuevos productos fortificados de forma eficiente que puedan alcanzar estos ácidos grasos esenciales a toda la población y, por sobre todo, afirmar su importancia desde la educación alimentaria nutricional en todos los niveles.
Referencias:
1. Simopoulos AP (1999) Evolutionary aspects fatty acids in the food supply of omega-3. Prostaglandins, Leukotrienes and Essential Fatty Acids 60(5&6): 421-429. DOI:10.1016/s0952-3278(99)80023-4.
2. Eaton SB, Konner M (1985) Paleolithic nutrition. A consideration of its nature and current implications. The New England Journal of Medicine 312: 283-289. DOI: 10.1056/NEJM198501313120505
3. Rodríguez–Cruz, Tovar, del Prado, Torres (2005) Mecanismos moleculares de acción de los ácidos grasos poliinsaturados y sus beneficios en la salud. Revista de investigación clínica 57 no.3: 457-472.
4. Shahidi F, Ambigaipalan P (2018) Omega-3 Polyunsaturated Fatty Acids and Their Health Benefits. Annual Review of Food Science and Technology 9:345-381. DOI: 10.1146/annurev-food-111317-095850
5. Arterburn LM, Hall EB, Oken H (2006) Distribution, interconversion, and dose response of n−3 fatty acids in humans. The American Journal of Clinical 83(6 Suppl):1467S-1476S. DOI: 10.1093/ajcn/83.6.1467S
6. Abedi E, Sahari MA (2014) Long-chain polyunsaturated fatty acid sources and evaluation of their nutritional and functional properties. Food Science & Nutrition 2, 443–463. DOI:10.1002/fsn3.121
7. FAO (2010) Fats and fatty acids in human nutrition. Report of an expert consultation. FAO Food and Nutrition Paper 91:1-166. PMID: 21812367.
8. Dietitians of Canada (2013) Food Sources of Omega-3 Fats.
9. Cholewski M, Tomczykowa M, Tomczyk M (2018) A Comprehensive Review of Chemistry, Sources and Bioavailability of Omega-3 Fatty Acids. Nutrients 10(11):1662. DOI: 10.3390/nu10111662
10. Shahidi F (1998) Functional seafood lipids and proteins. Functional Foods: Biochemical and Processing Aspects: 381–401.
11. Monroig Ó, Tocher DR, Navarro JC (2013) Biosynthesis of polyunsaturated fatty acids in marine invertebrates:Recent advances in molecular mechanisms. Marine Drugs 11: 3998–4018. DOI: 10.3390/md11103998
12. Mori TA (2017) Marine OMEGA-3 fatty acids in the prevention of cardiovascular disease. Fitoterapia 123: 51–58. DOI:10.1016/j.fitote.2017.09.015
13. Puri R, Mahajan M, Sahajpal NS, Singh H, Singh H, Jain SK (2016) Self-nanoemulsifying drug delivery system of docosahexanoic acid: Development, in vitro, in vivo characterization. Drug Development and Industrial Pharmacy 42: 1032–1041.
14. Simopoulos AP (1991) Omega-3 fatty acids in health and disease and in growth and development. The American Journal of Clinical Nutrition 54(3):438-63. DOI: 10.1093/ajcn/54.3.438
15. Simopoulos AP (2002) The importance of the ratio of omega-6/omega-3 essential fatty acids. Biomedicine & Pharmacotherapy 56(8):365-79. DOI: 10.1016/s0753-3322(02)00253-6
16. Doughman SD, Krupanidhi S, Sanjeevi CB (2007) Omega-3 fatty acids for nutrition and medicine: considering microalgae oil as a vegetarian source of EPA and DHA. Current Diabetes Review 3(3):198-203. DOI: 10.2174/157339907781368968
17. Harris WS (2006) The omega-6/omega-3 ratio and cardiovascular disease risk:uses and abuses. Current Atherosclerosis Reports 8(6): 453-459. DOI: 10.1007/s11883-006-0019-7
18. Grosso G, Galvano F, Marventano S, Malaguarnera M, Bucolo C, Drago F, Caraci F (2014) Omega-3 fatty acids and depression: scientific evidence and biological mechanisms. Oxidative Medicine and Cellular Longevity. 2014:313570 DOI: 10.1155/2014/313570
19. Shahidi F, Miraliakbari H (2004) Omega-3 (n-3) fatty acids in health and disease: part 1—cardiovascular disease and cancer. Journal of Medicine Food 7:387–401. DOI: 10.1089/jmf.2004.7.387
20. Phinney SD, Odin RS, Johnson SB, Holman RT (1990) Reduced arachidonate in serum phospholipids and cholesteryl esters associated with vegetarian diets in humans. American Journal of Clinical Nutrition 51(3):385-92. DOI:10.1093/ajcn/51.3.385
21. Kaur N, Chugh V, Gupta AK (2014) Essential fatty acids as functional components of foods- a review. Journal of food science and technology, 51(10), 2289–2303. DOI: 10.1007/s13197-012-0677-0
22. Taha AY, Cheon Y, Faurot KF, Macintosh B, Majchrzak-Hong SF, Mann JD, Hibbeln JR, Ringel A, Ramsden CE (2014) Dietary omega-6 fatty acid lowering increases bioavailability of omega-3 polyunsaturated fatty acids in human plasma lipid pools. Prostaglandins, leukotrienes, and essential fatty acids 90(5), 151–157. DOI: 10.1016/j.plefa.2014.02.003
23. Simopoulos AP (2002) Omega-3 fatty acids in inflammation and autoimmune diseases. Journal of the American College of Nutrition 21(6), 495–505. DOI:10.1080/07315724.2002.10719248
24. Montgomery HE, Clarkson P, Nwose OM, Mikailidis DP, Jagroop IA, Dollery C, Moult J, Benhizia F, Deanfield J, Jubb M, World M, McEwan JR, Winder A, Humphries S (1996) The acute rise in plasma fibrinogen concentration with exercise is influenced by the G-453-A polymorphism of the beta-fibrinogen gene. Arteriosclerosis, thrombosis, and vascular biology 16(3), 386–391. DOI: 10.1161/01.atv.16.3.386
25. Scott EM (1956) Nutrition of Alaskan Eskimos. Nutrition Reviews 14(1): 1-3. DOI: 10.1111/j.1753-4887.1956.tb01402.x
26. Bang HO, Dyerberg J, Sinclair HM (1980) The composition of the Eskimo food in north western Greenland. The American Journal of Clinical Nutrition 33(12): 2657-2661.DOI: 10.1093/ajcn/33.12.2657
27. Burr ML et al (1989) Effects of changes in fat, fish, and fibre intakes on death and myocardial reinfarction: diet and reinfarction trial (DART). Lancet 2: 757-761. DOI: 10.1016/s0140-6736(89)90828-3
28. Tavazzi L, Maggioni AP, Marchioli R, Barlera S, Franzosi MG, et al (2008) Effect of n-3 polyunsaturated fatty acids in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo controlled trial. Lancet 372:1223–1230. DOI: 10.1016/S0140-6736(08)61239-8
29. Kimmig LM, Karalis DG (2013) Do omega-3 polyunsaturated Fatty acids prevent cardiovascular disease? A review of the randomized clinical trials. Lipid Insights 6: 13-20. DOI: 10.4137/LPI.S10846
30. Jones PJ, Senanayake VK, Pu S, Jenkins DJ, Connelly PW, et al (2014) DHA-enriched high–oleic acid canola oil improves lipid profile and lowers predicted cardiovascular disease risk in the canola oil multicenter randomized controlled trial. The American Journal of Clinical Nutrition 100:88–97. DOI: 10.3945/ajcn.113.081133
31. Farrell SW, et al (2020) Higher omega-3 index is associated with more rapid heart rate recovery in healthy men and women. Prostaglandins, Leukotrienes and Essential Fatty Acids 163:102206. DOI: 10.1016/j.plefa.2020.102206
32. Hernesniemi, JA, et al (2020) Cardiorespiratory fitness and heart rate recovery predict sudden cardiac death regardless of ejection fraction. Heart 106: 434-440 .DOI: 10.1136/heartjnl-2019-315198
33. NIH: National Institutes of Health (2020) Omega-3 Fatty Acids Fact Sheet for Health Professionals.
34. Ma DW, Seo J, Switzer KC, Fan YY, McMurray DN, Lupton JR. Chapkin RS (2004) n-3 PUFA and membrane microdomains: a new frontier in bioactive lipid research. The Journal of nutritional biochemistry 15(11), 700–706. DOI: 10.1016/j.jnutbio.2004.08.002
35. Kromhout D, Yasuda S, Geleijnse JM, Shimokawa H (2012) Fish oil and omega-3 fatty acids in cardiovascular disease: do they really work?. European heart journal 33(4), 436–443. DOI: 10.1093/eurheartj/ehr362
36. Sampath H, Ntambi JM (2005) Polyunsaturated fatty acid regulation of genes of lipid metabolism. Annual Review of Nutrition 25:317–340. DOI:10.1146/annurev.nutr.25.051804.101917
37. Goodfellow J, Bellamy MF, Ramsey MW, Jones CJ, Lewis MJ (2000) Dietary supplementation with marine omega-3 fatty acids improve systemic large artery endothelial function in subjects with hypercholesterolemia. Journal of the American College of Cardiology 35(2), 265–270. DOI: 10.1016/s0735-1097(99)00548-3
38. Abeywardena MY, Head RJ (2001) Longchain n-3 polyunsaturated fatty acids and blood vessel function. Cardiovascular research 52(3), 361–371. DOI: 10.1016/s0008-6363(01)00406-0
39. Duda MK, O'Shea KM, Stanley WC (2009) Omega-3 polyunsaturated fatty acid supplementation for the treatment of heart failure: mechanisms and clinical potential. Cardiovascular research 84(1), 33–41. DOI: 10.1093/cvr/cvp169
40. Institute of Medicine, Food and Nutrition Board (2005) Dietary reference intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein, and amino acids (macronutrients). National Academy Press. DOI: 10.17226/10490
41. Dunstan JA, Simmer K, Dixon C, Prescott SL (2008) Cognitive assessment of children at age 2(1/2) years after maternal fish oil supplementation in pregnancy: a randomised controlled trial. Archives of Disease in Childhood: Fetal and Neonatal Edition 93(1): F45-50. DOI: 10.1136/adc.2006.099085
42. Judge MP, Harel O, Lammi-Keefe CJ (2007) A docosahexaenoic acid–functional food during pregnancy benefits infant visual acuity at four but not six months of age. Lipids 42:117–122. DOI: 10.1007/s11745-006-3007-3
43. Carlson SE, Colombo J, Gajewski BJ, Gustafson KM, Mundy D, et al (2013) DHA supplementation and pregnancy outcomes. The American Journal of Clinical Nutrition 97:808–815. DOI: 10.3945/ajcn.112.050021
44. Best KP, Gold M, Kennedy D, Martin J, Makrides M (2016) Omega-3 long-chain PUFA intake during pregnancy and allergic disease outcomes in the offspring: a systematic review and meta-analysis of observational studies and randomized controlled trials. The American Journal of Clinical Nutrition 103:128–143. DOI: 10.3945/ajcn.115.111104
45. Cederholm T (2017) Fish consumption and omega-3 fatty acid supplementation for prevention or treatment of cognitive decline, dementia or Alzheimer’s disease in older adults: any news?. Current Opinion on Clinical Nutrition and Metabolic Care 20: 104–109. DOI: 10.1097/MCO.0000000000000350
46. Nemets H, Nemets B, Apter A, Bracha Z, Belmaker RH (2006) Omega-3 treatment of childhood depression: a controlled, double-blind pilot study. The American Journal of Psychiatry 163(6):1098–1100. DOI: 10.1176/ajp.2006.163.6.1098
47. Rice SM, Hickie IB, Yung AR, Mackinnon A, Berk M, et al (2016) Youth depression alleviation: the Fish Oil Youth Depression Study (YoDA-F): a randomized, double-blind, placebo-controlled treatment trial. Early Intervention in Psychiatry 10:290–299. DOI: 10.1111/eip.12166
48. Yehuda S, Rabinovitz S, Mostofsky DI (2005) Essential fatty acids and the brain: from infancy to aging. Neurobiology of aging 26 Suppl 1, 98–102. DOI: 10.1016/j.neurobiolaging.2005.09.013
49. Costantini L, Molinari R, Farinon B, Merendino N (2017) Impact of Omega-3 Fatty Acids on the Gut Microbiota. International Journal of Molecular Sciences 18(12):2645.DOI: 10.3390/ijms18122645
50. Prepare-it. https://prepare-it.org/ accesado 01/02/2021
51. Kris-Etherton PM, Harris WS, Appel LJ, American Heart Association, Nutrition Committee (2003) Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular disease. Circulation 106:2747–2757. DOI: 10.1161/01.cir.0000038493.65177.94
52. Trumbo P, Schlicker S, Yates AA, Poos M (2002) Dietary reference intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein and amino acids. Journal of the American Dietetic Association 102(11):1621–1630. DOI: 10.1016/s0002-8223(02)90346-9
53. Ganesan B, Brothersen C, McMahon DJ (2014) Fortification of foods with omega-3 polyunsaturated fatty acids. Critical Reviews in Food Science and Nutrition 54(1):98-114. DOI: 10.1080/10408398.2011.578221
54. Yehuda S (2003) Omega-6/omega-3 ratio and brain-related functions. World review of nutrition and dietetics 92: 37-56. DOI: 10.1159/000073791
55. Gerster H (1998) Can adults adequately convert alpha-linolenic acid (18:3n-3) to eicosapentaenoic acid (20:5n-3) and docosahexaenoic acid (22:6n-3)? International Journal for vitamin and nutritional research 68: 159–173.
56. Valenzuela A (2009) Aceites de origen marino y su importancia en la salud y nutrición humana y animal. Aceites Grasas XIX: 154-161.
57. Taneja A, Singh H (2012) Challenges for the delivery of long-chain fatty acids in functional foods. Annual Review of Food Science and Technology 3: 105-23. DOI: 10.1146/annurev-food-022811-101130
58. Schuchardt JP, Hahn A (2013) Bioavailability of long-chain omega-3 fatty acids. Prostaglandins, Leukotrienes and Essential Fatty Acids 89, 1–8. DOI: 10.1016/j.plefa.2013.03.010
59. Qin Y, Nyheim H, Haram EM, Moritz JM, Hustvedt SO (2017) A novel self-micro-emulsifying delivery system (SMEDS) formulation significantly improves the fasting absorption of EPA and DHA from a single dose of an omega-3 ethyl ester concentrate. Lipids in health and disease 16(1): 204. DOI:10.1186/s12944-017-0589-0
60. Lock AL, Bauman DE (2004) Modifying milk fat composition of dairy cows to enhance fatty acids beneficial to human health. Lipids 39(12):1197–1206. DOI: 10.1007/s11745-004-1348-6
61. Kankaanpää P, Salminen S, Isolauri E, Lee Y (2001) The influence of polyunsaturated fatty acids on probiotic growth and adhesion. FEMS Microbiology Letters 194 (2), 149–153. DOI: 10.1111/j.1574-6968.2001.tb09460.x
62. Kankaanpää P, Yang B, Kallio H, Isolauri E, Salminen S (2004) Effects of Polyunsaturated Fatty Acids in Growth Medium on Lipid Composition and on Physicochemical Surface Properties of Lactobacilli. Applied and Environmental Microbiology 70 (1): 129-136. DOI: 10.1128/AEM.70.1.129-136.2004
63. Eratte D, Wang B, Dowling K, Barrow C, Adhikari B (2016) Survival and fermentation activity of probiotic bacteria and oxidative stability of omega-3 oil in co-microcapsules during storage. Journal of Functional Foods 23, 485-496. DOI: 10.1016/j.jff.2016.03.005
64. Robertson R, Mateo M, O’Grady M, Guihéneuf F, Stengel DB, Ross RP, Fitzgerald G, Kerry J, Stanton C (2016) An assessment of the techno-functional and sensory properties of yoghurt fortified with a lipid extract from the microalga Pavlova lutheri. Innovative Food Science and Emerging Technologies 37: 237-246. DOI: 10.1016/j.ifset.2016.03.017
|
Revista QuímicaViva Número 1, año 20, Abril 2021 quimicaviva@qb.fcen.uba.ar |