Nanomateriales: conceptos, aplicación en nanoterapia y regulaciones
Susana Lucía Estrada-Flores*. César Garcias-Morales. Catalina M. Pérez Berumen. Liliana Cantu-Sifuentes.
Departamento de Química Orgánica, Facultad de Ciencias Químicas, Universidad Autónoma de Coahuila, 25280 Saltillo, Coahuila, México
Recibido: 17-02-2023 - Aceptado: 09-03-2023
Resumen
El desarrollo de la nanotecnología ha permitido obtener una gran cantidad de nanomateriales, que dependiendo de la forma y tamaño pueden presentar diferentes propiedades fisicoquímicas. El campo de aplicación de los nanomateriales es muy amplio y, recientemente se ha estudiado su aplicación en el área de la medicina, es por esta razón que, en este documento dirigido a estudiantes en el área de ciencias, se abordan conceptos básicos de la nanotecnología, tipos de nanomateriales, clasificación, métodos de obtención, relación de las propiedades fisicoquímicas con la estructura, campos de aplicación y regulación. Se resalta el empleo de los nanomateriales en el campo de la medicina y su aplicación en el diagnóstico de diferentes tipos de cáncer, así como su aplicación en la terapia fotodinámica. Se presentan algunos casos en los cuales se han empleado agentes teragnósticos en terapias fotodinámicas y la importancia de la regulación al poder implicar algún riesgo.
Palabras clave: Nanomateriales, Nanotecnología, Nanomedicina, Nanopartículas, Nanoterapia
Nanomaterials: concepts, application in nanotherapy and regulations
Summary
Nanotechnology has made it possible to obtain many nanomaterials with different physicochemical properties depending on their shape and size. The field of application of nanomaterials is vast, and recently, their application in medicine has been studied: for this reason, this document addresses basic concepts of nanomaterials, types, classification, manufacturing methods, the relationship of the physicochemical properties with the structure, fields of application and regulation. The use of nanomaterials in the field of medicine and their application in the diagnosis of different types of cancer and their application in photodynamic therapy is highlighted. Some cases are presented in which theragnostic agents have been used in photodynamic therapies and the importance of regulating their use and risks.
Keywords: Nanomaterials, Nanotechnology, Nanomedicine, Nanoparticles, Nanotherapy
Introducción
Los nanomateriales (NM) han ganado importancia gracias a que presentan propiedades fisicoquímicas diferentes que el compuesto químico equivalente a un tamaño macroscópico. existen varias definiciones para un nanomaterial, la más aceptada es el que lo define como aquel material en el que por lo menos una de sus dimensiones (x, y o z) se encuentra en el tamaño de la nanoescala (1 a 100 nm). La Administración de Drogas y Alimentos de EE. UU. (USFDA) define a los NM como “materiales que tienen al menos una dimensión en el rango de aproximadamente 1 a 100 nm y exhiben fenómenos dependientes de la dimensión” es decir efectos cuánticos;[1] mientras que la Institución de Estándares Británicos define a las nanopartículas (NP) como un nano-objeto cuyas tres dimensiones se encuentran dentro de la nanoescala.[2]
Por otra parte, se ha definido a la nanotecnología como la ciencia que se encarga de estudiar la manipulación y aplicación de la materia que se encuentra en el tamaño de la nanoescala; gracias a esta rama de la ciencia es posible entender y desarrollar nuevos NM y NP con aplicación en diferentes áreas de la ciencia como la nanomedicina, donde el 53% de las nanoterapias que se estudian son para combatir el cáncer, encontrándose en su mayoría en las fases clínicas I y II.[3,4]
Por esta razón el objetivo de este artículo de revisión es proveer a los estudiantes del área de ciencias una introducción a la nanotecnología y a los NM, los métodos de obtención, el área de aplicación en la medicina y las regulaciones nacionales e internacionales, debido a que esta rama de la ciencia promete encontrar eficaces tratamientos para diferentes patologías.
Evolución de la nanotecnología a través del tiempo
El uso de NM se remonta a las primeras civilizaciones, ya que se tiene conocimiento de que el primer colorante sintético data del siglo III a.C. conocido como “azul egipcio”, éste resulta ser nanoestructuras de CaCuSi4O10 y SiO2 con tamaños de ~5 nm.[5] Incluso en la época medieval se fabricaron diversos vitrales preparados con óxidos de plata con formas y tamaño de partículas distintas, el color rojo se observaba cuando el NM era de un tamaño de ~100 nm y morfología triangular, el azul claro con esferas un tamaño de ~90 nm y el azul oscuro con esferas de ~40 nm; donde la resonancia de plasmón superficial (Figura 1) es la responsable de la variación de las propiedades ópticas, ya que cuando la luz incide en el nanomaterial el campo electromagnético empieza a vibrar a la misma frecuencia de los electrones en la superficie de la NP denominado plasmón, lo que lleva a un cambio en la zona de emisión del espectro electromagnético por las variaciones en las oscilaciones y frecuencias de emisión.[6]
Al observarse a través de la historia que los NM presentan variaciones en sus propiedades optoelectrónicas y fisicoquímicas dependiendo de su morfología y tamaño, la comunidad científica ha concluido que el comportamiento de los materiales que se encuentran en la nanoescala no se rige por las leyes de la física clásica.
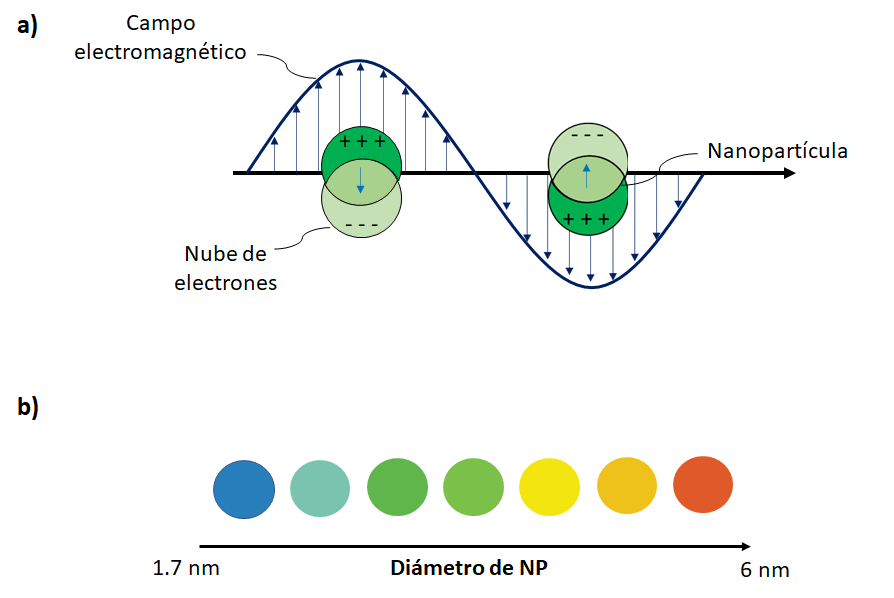
Figura 1: a) Fenómeno de resonancia de plasmón superficial. b) Cambio de las propiedades ópticas de nanopartículas metálicas de Cd desde 1.7 nm de diámetro hasta 6 nm.[7]
En 1959 Richard Feynman (premio Nobel de física 1965) expuso las primeras ideas de la nanotecnología, en su discurso dictado en la Sociedad Americana de Física expuso “Hay mucho espacio en el fondo” refiriéndose a las diversas actividades que pequeños organismos como las células podían realizar. En 1974 Norio Taniguchi utilizó por vez primera la palabra “nanotecnología” refiriéndose a una técnica de producción en escala nanométrica.[8]
En 1998 Thomas Webster publicó la síntesis y uso de nanomateriales para inhibir el crecimiento de bacterias, evitar la inflamación y promover el crecimiento de tejido; y es a partir de este siglo que se han comenzado a desarrollar tratamientos clínicos en base a nanopartículas para combatir diversas enfermedades.[9]
Clasificación de los NM
Existe una diversidad muy grande de NM con diferentes formas y tamaños, la cual está relacionada con las propiedades ópticas, electrónicas, catalíticas y magnéticas, por lo que estos pueden ser clasificados según la medida de las dimensiones de sus componentes en las direcciones x, y, z en cuatro categorías (Figura 2):
- Dimensión cero (0D): En esta clasificación las tres dimensiones del NM x, y, z se encuentran dentro de la escala nanométrica donde el diámetro es menor de 100 nm. Dentro de esta clasificación podemos encontrar las nanopartículas, nanocristales y nanoclusters.
- Monodimensionales (1D): Son aquellos NM en los cuales dos de sus dimensiones x, y, z se encuentran dentro de la escala nanométrica (1-100 nm); aquí podemos encontrar las estructuras cristalinas alargadas conocidas como nanohilos o nanocables, estos NM destacan por sus propiedades semiconductoras. Otra nanoestructura clasificada en este tipo de NM son los nanotubos los cuales presentan una estructura tubular con un hueco en el centro, los más conocidos son los nanotubos de carbono o CNT (Carbon nanotubes).
- Bidimensionales (2D): son aquellos nanomateriales donde solo una de sus dimensiones se encuentra en la nanoescala, y su estructura se compone de capas delgadas conocidas como nanocapas o películas delgadas de 1-100 nm de espesor; un ejemplo muy común es el grafeno que se destaca por sus propiedades de conducción.
- Tridimensionales (3D): se refiere a aquellos materiales cuya estructura interna está formada por nanoestructuras más pequeñas (moléculas) o que su tamaño sea cercano a ~100 nm.[10]
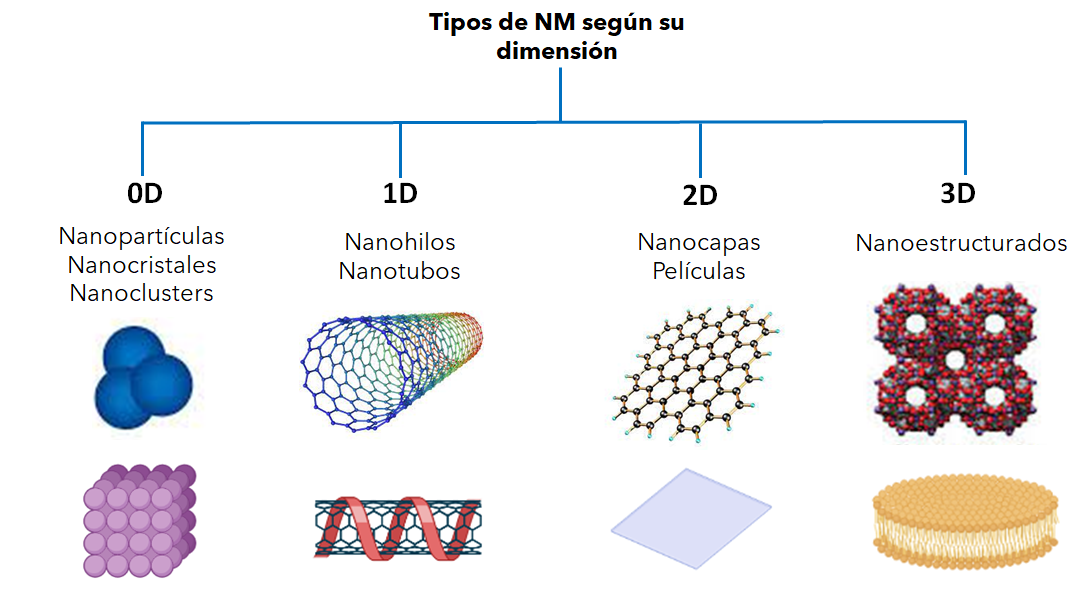
Figura 2: Clasificación de los NM según su dimensionalidad x,y, z.
Síntesis de NM
La fabricación de NM de forma química, física o biológica, se lleva a cabo mediante dos estrategias principalmente (Figura 3), la primera conocida como Top down la cual consiste en la división de un material a macroescala mediante procesos físicos o químicos hasta llegar a formar partículas de tamaño nanométrico, esta reducción de tamaño de macro escala se puede llevar a cabo por: deposición química en fase vapor que consiste en la formación de una película o capa delgada en la superficie de un material por medio de la sublimación de una molécula volátil dentro de una cámara al vacío; evaporación térmica donde se da la formación de una nanocapa en la superficie de un sustrato mediante el calentamiento y evaporación de las moléculas que se depositarán; implantación de iones que da la formación de nanoestructuras en un sustrato por medio de la implantación de iones de un material distinto a este, cambiando sus propiedades fisicoquímicas; la molienda mecánica intensiva consiste en la reducción del tamaño de partícula utilizando un molino bajo condiciones controladas y la ablación láser donde con ayuda de un láser que incide a un material en sólido o líquido se desprenden nanoestructuras de la superficie de alta pureza. [11,12]
La segunda estrategia para la fabricación de nanopartículas es conocida como “de abajo hacia arriba” (Bottom up), la cual consiste en la formación de nanopartículas mediante la unión de átomos o moléculas hasta alcanzar la escala nanométrica, utilizando generalmente procesos químicos o biológicos dentro de los cuales podemos encontrar: reducción fotoquímica o radioquímica que da formación de NP en su mayoría metálicas mediante energías de 60 a 104 eV con el uso de electrones, radicales o especies excitadas; método de microemulsiones que consiste en la estabilización de dos agentes no miscibles con la ayuda de un surfactante, formando partículas de tamaño nanométrico; microondas en donde la energía del equipo provoca colisiones que llevan a cabo reacciones químicas dando lugar a la formación de NP; reacciones redox que emplean agentes reductores y oxidantes para la formación de nanopartículas partiendo de sales metálicas; extracciones biológicas realizadas a partir de hongos, plantas, algas o microorganismos en agitación con una disolución del metal precursor de la NP, de manera que mediante la metabolización de este se lleve a cabo la formación de la partícula a escala nanométrica, esto debido a los enzimas de los organismos y de tejidos de plantas donde intervienen polisacáridos, proteínas, aminoácidos, polifenoles, ácidos orgánicos y terpenoides.[13-16]
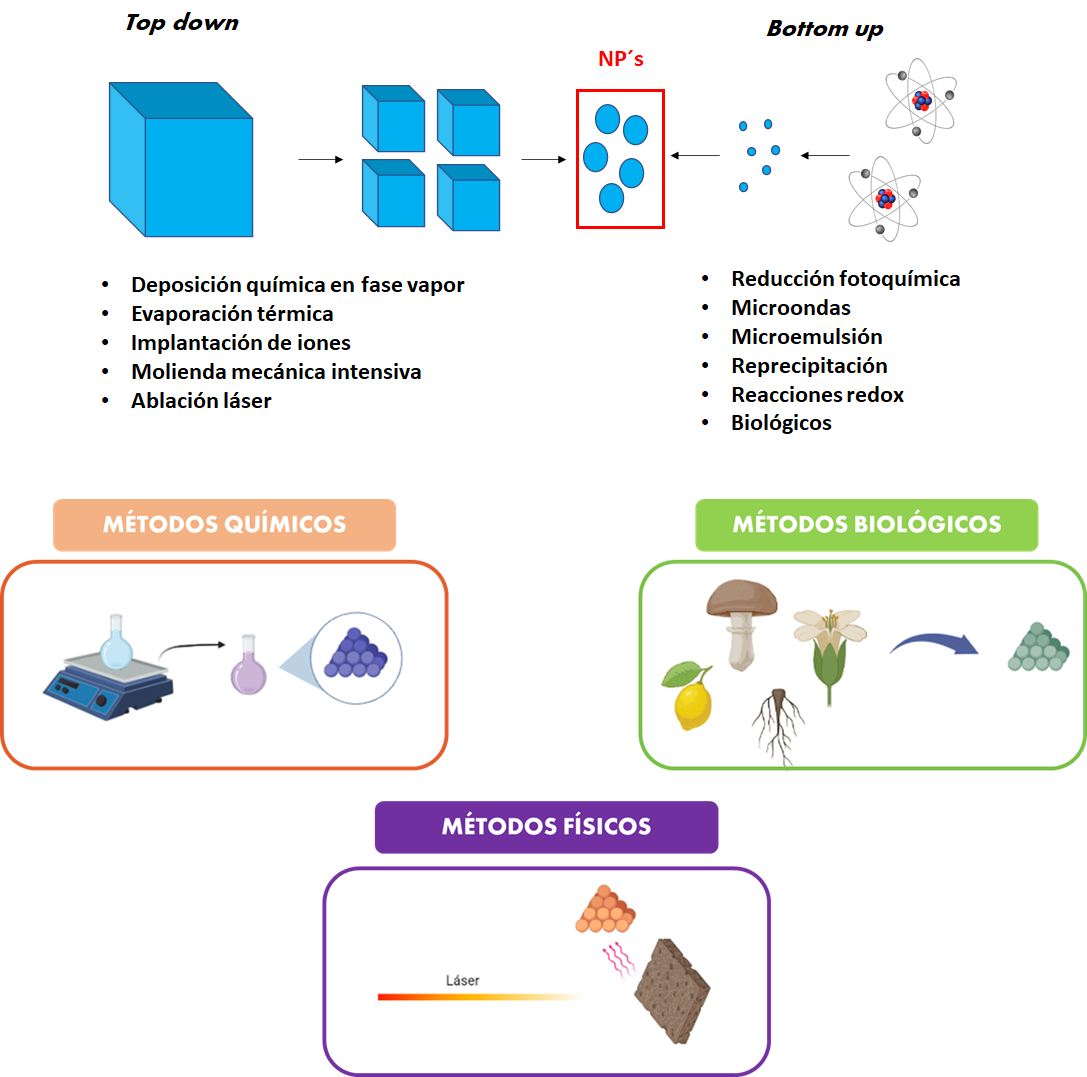
Figura 3: Métodos de síntesis de NP.
Uso de NM en terapia médica
Los nanomateriales se han empleado en el área de la medicina como una alternativa para tratamientos de algunas enfermedades como medios no invasivos, así como agentes de diagnóstico minimizando los efectos secundarios provocados por sustancias toxicas; cuando un NM tiene la capacidad de realizar el tratamiento y el diagnóstico de una patología se le conoce como agente teragnóstico. [17]
Dependiendo de su función y propiedades fisicoquímicas podemos clasificar a los agentes teragnósticos en seis tipos (Figura 4) que incluyen el uso de NP: liberación de fármacos, terapia de genes, terapia fototérmica PTT (Photothermal Therapy), terapia magnetocitolítica y terapia fotodinámica PDT (Photodynamic Therapy), la cual se resalta debido a su desarrollo en los últimos años y su efectividad como tratamiento en patologías de piel y algunos tipos de tumores. [18]
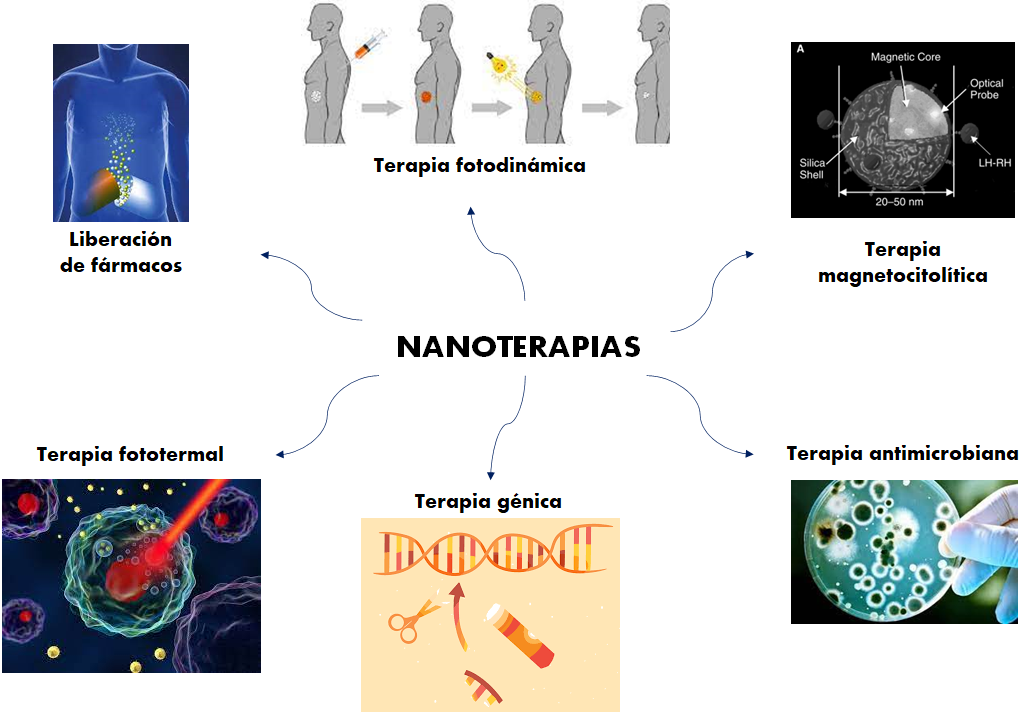
Figura 4: Diferentes tipos de nanoterapias.
La liberación de fármacos consiste en el uso de nanosistemas bioconjugados que sean capaces de administrar un fármaco de forma selectiva a un sitio específico ya sea órgano, célula o tejido dentro del cuerpo humano; se han desarrollado algunos nanosistemas llamados “plataformas multifuncionales de liberación” que tienen la ventaja de que además de su efecto terapéutico es posible realizar el rastreo de las NP por medio de técnicas de imagen y de esta forma realizar el diagnóstico de alguna patología; una de las moléculas orgánicas utilizadas en este tipo de terapia es la doxorrubicina que al ser bioconjugada con polietilenglicol (PEG) en un sistema liposomal presenta una reducción de células cancerosas mostrando cargas de cáncer residual (RCB) de 13,7% en células de cáncer de mama, ovario y sarcoma de Kaposi (Figura 5).[19,20] Se ha probado la modificación superficial de antibióticos como la rodamina forrándose con precursores de sílice utilizando aminopropiltrietoxisilano (APTES) por el método de Söber y obteniendo NP de específica liberación en sistemas infecciosos de Escherichia coli y Bacillus subtilis.[21]
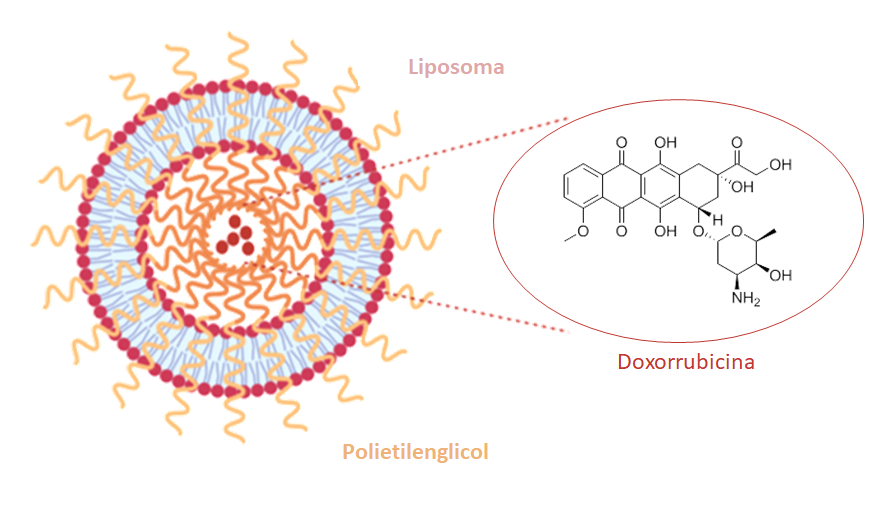
Figura 5: Sistema de liberación de doxorrubicina.
La PDT emplea moléculas orgánicas como fotosensibilizadores (PS), que al ser administradas dentro del cuerpo pueden dirigirse selectivamente a cierto tipo de células mediante una bioconjugación. Posteriormente cuando la molécula es excitada a cierta longitud de onda, esta genera especies reactivas de oxígeno (ROS) como el oxígeno singulete (1O2) que es el estado excitado del oxígeno molecular. Sin embargo, se debe tener cuidado ya que eta especie es tan reactiva que puede dañar tanto células enfermas como células sanas, e incluso vasos sanguíneos o producir la degradación de la membrana y núcleo celular de células patógenas ocasionando la muerte celular; si el fotosensibilizador presenta fenómenos como la fluorescencia o está funcionalizada con alguna molécula marcadora es posible emplearlos como agente teragnóstico (Figura 6).[17]
Un fotosensibilizador debe cumplir con ciertas especificaciones para poder ser empleado en PDT, dentro de las cuales se encuentran el ser capaces de pasar de un estado basal a uno excitado por medio de la absorción de la radiación en una longitud de onda en la región infrarroja comprendida de 600-850 nm; generar ROS como 1O2; poseer buena estabilidad química y fotoquímica; presentar un alto rendimiento cuántico de fluorescencia (ФF) en caso de también ser utilizado como agente de contraste; tener un alto rendimiento cuántico de formación de tripletes, un alto rendimiento cuántico de 1O2 y una alta energía de estado de triplete; presentar citotoxicidad nula o mínima en estado basal; ser selectivo a las células objetivo; poder ser eliminado del cuerpo rápidamente y ser biocompatibles.

Figura 6: Esquema general de funcionamiento de la terapia fotodinámica.
La estructura electrónica de las moléculas empleadas como fotosensibilizadores o biomarcadores es donador - aceptor (D-A), con un sistema π-conjugado que permita la absorción de la luz en la región del espectro visible. La longitud de onda que las moléculas pueden absorber depende de la energía de band gap (Eg) de la molécula el cual es la diferencia entre la energía del orbital molecular ocupado de mayor energía (HOMO) y el orbital molecular desocupado de menor energía (LUMO) Eg= HOMO-LUMO, y esta a su vez depende de la cantidad de dobles enlaces conjugados, que junto con la planaridad de la molécula o la restricción del movimiento intramolecular de la misma con la formación de agregados (fenómeno de Emisión Inducida por Agregación) afectan la posición de la banda de absorción.[22-24]
En la actualidad existen moléculas orgánicas que ya han sido utilizadas en terapia fotodinámica como Photofrin o porfímero sódico en forma de nanopartículas bioconjugadas con PEG de ~40 nm que son excitadas a una longitud de onda de 630 nm principalmente en células de carcinoma de mama murino CT26.WT disminuyendo la viabilidad celular hasta menos del 10% luego de 12 horas de irradiación después de 15 días de inyectar el PS.[25,26]
El ácido 5-aminolevulínico (Figura 7a) es utilizado en PDT en lesiones de piel y se puede aplicar ya sea de forma tópica, parenteral o por vía oral, sin embargo, este fotosensibilizador tiene algunas desventajas, en el caso de ser inyección intralesional los pacientes refieren dolor y al ser administrado de forma oral tiene poca acumulación en el tejido tumoral. Al utilizar este fotosensibilizador se ha reportado en pacientes con cáncer de vejiga no músculo-invasivo la disminución del tumor del 90,7 %, con un 96% de sensibilidad y un 52% de especificidad a las células cancerosas.[27]
Moléculas derivadas de porfirinas en forma de nanopartículas las cuales son solubles en agua, se encuentran bajo estudios de citotoxicidad, caracterización fotofísica, generación de oxígeno singulete y toxicología (Figura 7b). Tal es el caso de las porfirinas tetracatiónicas que presentan un ФF de 67% al ser excitadas a una longitud de onda de 660 nm y una tasa de fotooxidación de k= 2.3 × 10-6 min-1 en adenovirus bovino [28]. Estudios de PDT en líneas celulares de cáncer de ovario (OVCAR-3) han concluido que nanopartículas lipídicas de verteporfirina presentan una alta selectividad; NP tipo core-shell bioconjugadas con polimetilmetacrilato (PMMA) de porfirina funcionan también como biomarcadores y al fabricar NP de diámetros de 30 nm a 1 μm de diarilporfirina con PMMA mediante el método de microemulsión se aumenta 1.7 veces más el rendimiento cuántico de oxígeno singulete y al incluir flúor en la estructura de la porfirina junto con la bioconjugación con polientilenglicol (PEG) aumenta la eficiencia del tratamiento al ser excitada en una longitud de onda de ~660 nm.[29,30]
Las NP de clorinas (Figura 7c) basados en tetrapirroles han sido reportadas por tener una mayor absorción en la región del infrarrojo lejano (640-700 nm) debido a que presentan el fenómeno de emisión inducida por agregación (AIE) y por aumentar la selectividad hacia líneas celulares diana, el Foscan™ es un PS que ya se comercializa para el tratamiento de carcinomas de células escamosas de cabeza y cuello, sin embargo continúa la investigación de este tipo de fotosensibilizadores debido a que los pacientes pueden presentar efectos en la piel como la fotosensibilidad. La mesotetrahidroxifenilclorina (m-THPC) formulada mediante microemulsión en forma de liposomas muestra un rendimiento cuántico de oxígeno singulete de 30%, un coeficiente de absorción molar de 150 000 M-1cm-1 y el fenómeno de fluorescencia al ser excitado a 630 nm en células de cáncer de piel.[31]
Las texafirinas (Figura 7d) y las ftalocianinas son compuestos organometálicos con los que se ha llevado a cabo ensayos en ratones con lesiones malignas, y en pacientes con sarcoma de Kaposi y metástasis cutánea de cáncer de mama; uno de ellos es la texafirina de lutecio que tiene un pico máximo de absorción en la región de 732 nm administrado por vía intravenosa. La nanotexafirina bioconjugada con PEG y ácido fólico, excitada a una longitud de onda de 592 nm presentaba alta fluorescencia, funcionando como biomarcador en la línea celular CT26 y HepG2; al agregar Zn y Fe a la estructura se obtenían NP de 15 nm de diámetro con propiedades magnéticas que le daban características para ser utilizado además como un liberador de fármaco selectivo.[32-35]
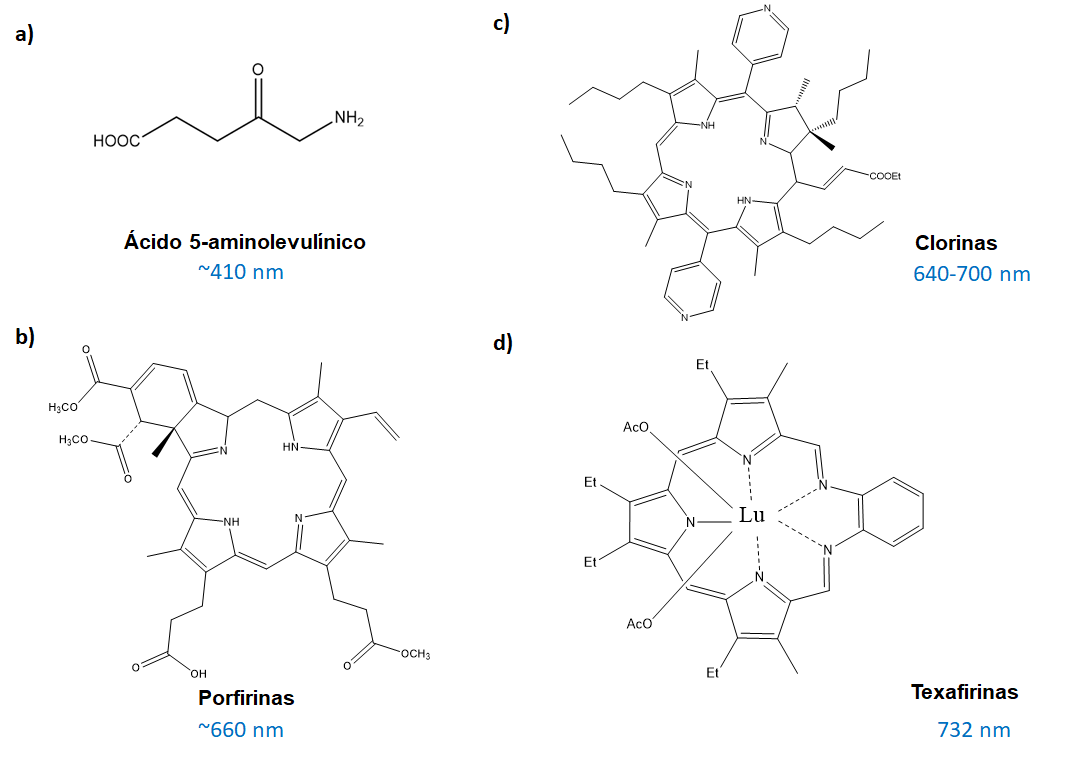
Figura 7: Moléculas orgánicas utilizadas como PS y λ de excitación.
Existen PS orgánicos que no pueden ser excitados en la longitud de onda del infrarrojo cercano, para poder ser utilizados en las nanoterapias se utiliza el proceso de absorción de dos fotones (TPA), tal es el caso de las NP fabricadas por microemulsión de monómero de fluoreno 4,7-bis[2-(9,9-dimetil)fluorenil]benzo[1,2,5]tiadiazol utilizando al CTAB y Tritón X-100 como surfactantes, presentaban una absorción máxima en 415 nm, una viabiliad celular de 50% en células HeLa y de 80% al estar forradas con precursores de sílice.[36]
La PDT actualmente solo se puede utilizar en tejidos u órganos que son alcanzables para la fuente de radiación, es decir, solo aquellos que se encuentran en la piel o el revestimiento de los órganos; y los pacientes que se someten al tratamiento pueden llegar a tener sensibilidad a la luz durante algún tiempo dependiendo de la forma en la que se administró el PS.[37]–[41]
Regulaciones en nanomedicina
Aunque el avance de la nanomedicina ha aumentado en la última década, siguen existiendo algunas problemáticas con el uso de NM en cuanto a las respuestas que pueden generar al interactuar con el cuerpo humano; debido al tamaño, morfología y composición de las nanopartículas es posible que presenten cierta toxicidad pues son agentes extraños al medio fisiológico.
Dentro de los principales daños causados por el uso de NP se encuentra la generación anormal de ROS en donde comienza la lisis de las células conocido como estrés oxidativo; la genotoxicidad que se refiere al daño causado en el ADN que incluye su fragmentación, rotura y la supresión de las funciones de replicación y transcripción; la inmunogenicidad que ocurre cuando el sistema inmunológico da una respuesta inflamatoria por citocinas debido a que encuentra invasiva la presencia de las nanopartículas; y finalmente una alteración en la apoptosis de las células.[42]
Por esta razón es necesario la regulación de las aplicaciones de los NM en la nanomedicina, si bien no existe una normativa armonizada internacionalmente, ya existen algunos estándares a seguir dependiendo del país de origen. La Unión Europea sigue lineamientos como el “Reglamento de Registro, Evaluación, Autorización y Restricción de las Sustancias y Preparados Químicos” (REACH). En Estados Unidos se cuenta con el Department of Health and Human Services de la Food and Drug Administration (FDA). Mientras que en México, la Secretaría de Economía en 2017 instituyó el Comité Técnico de Normalización Nacional en Nanotecnologías (CTNNN) para regular el comercio de productos, manejo y disposición de residuos de nanomateriales mediante Normas Oficiales Mexicanas (NOMs), en especial importancia la NMX-R-12901-1-SCFI titulada “Nanotecnologías-Gestión de riesgo ocupacional aplicado a nanomateriales manufacturados”, la cual ofrece las medidas del manejo de los NM manufacturados, protocolos de seguridad en caso de accidentes así como las especificaciones del uso de nanopartículas, nanofibras, nanotubos, nanoalambres, agregados y aglomerados definidos como NOAA.[43-45]
Organizaciones que dictan pautas internacionales como ISO y ASTM han publicado estándares para la salud y seguridad ambiental (EHS). La ISO/TC 229 establece clasificación, terminología, riesgos y métodos para determinar las propiedades físicas y químicas de los NM, donde en Estados Unidos el Panel de Estándares de Nanotecnología del Instituto Nacional Estadounidense de Estándares (ANSI-NSP) sirve como un organismo complementario. En 2005 se formó el Comité E56 de la ASTM, el cual coordina la normalización con las necesidades de la nanotecnología.[46-49]
Empresas internacionales del sector público y privado han tratado de armonizar los lineamientos para la producción y comercialización de NM en todo el mundo con el fin de garantizar la seguridad de la salud humana y ambiental; por esta razón empresas y organizaciones como Joint Research Center, la Organización Internacional de Normalización, DuPont, BASF, Certifiable Nanospecific Risk Management and Monitoring System (CENARIOS) y Precautionary Matrix for Synthetic Nanomaterials de Suiza, han dividido las normativas en las siguientes secciones según su aplicación (Tabla I).
Tabla I: Lineamientos de NM clasificadas según su aplicación.[50]
| Tipo de norma | Información que proporciona | Ejemplo |
|---|---|---|
| Registro | Presentan información acerca del cuidado del ambiente laboral para el trabajador y el medio ambiente, es especial abordando el tema de gestión de riesgos | Nanoscale Materials Stewardship Program de la Agencia de Protección Ambiental de Estados Unidos |
| Etiquetado | Brindar información al comprador acerca del contenido de los productos que contienen NM con el fin de que el consumidor realice compras informadas | ISO/TS 1383: Guía para el etiquetado voluntario de productos al consumidor que contengan nano objetos |
| Códigos de conducta | Instrumentos para el desarrollo de NM de forma responsable, segura, sustentable y ética | BASF Code of Conduct Nanotechnology |
| Guía | Establecen bases para procesos de elaboración de NM con las mismas características | Guías del Testing Programme of Manufactured Nanomaterials elaboradas por el Working Programe on Manufacture Nanomaterials |
| Sistemas de manejo de riesgos | Sistemas que ayudan a gestionar los riesgos corporativos | NanoRisk Framework de DuPont |
| Normas técnicas | Documento que estandariza procedimientos de uso global que aseguran la fiabilidad de NM | E3089 Efectos del tamaño de los NM en sus propiedades de American Society for Testing and Materials (ASTM) |
Conclusiones
La nanotecnología ha resultado ser de gran importancia a lo largo de la historia permitiendo la fabricación de nuevos NM con propiedades dependientes de su tamaño y morfología.
Gracias a sus propiedades fisicoquímicas se destaca su aplicación en diferentes ámbitos destacando la nanomedicina donde las nanoterapias prometen alternativas de tratamiento y diagnóstico con la ventaja de disminuir los efectos secundarios en comparación con otros tipos de tratamientos.
Debido al impacto que tiene en la nanotecnología globalmente, es necesario una armonización internacional y nacional de los lineamientos que existen para la producción, comercialización y disposición de deshechos de NM que ayuden a solidificar su correcto manejo.
Agradecimientos
Agradecemos al apoyo financiero que se ha brindado con la Beca CONACyT número 787927 para la formación de maestría de la Q. Susana Lucía Estrada Flores en el programa de Maestría en Ciencia y Tecnología Química de la Universidad Autónoma de Coahuila.
Referencias:
1. U.S. Department of Health and Human Services, Food and Drug Administration, and Office of the Commissioner, “Guidance for Industry Considering Whether an FDA-Regulated Product Involves the Application of Nanotechnology Contains Nonbinding Recommendations,” 2014, Accessed: Oct. 06, 2021. [Online]. Available: http://www.fda.gov/RegulatoryInformation/Guidances/ucm257698.htm
2. J Jeevanandam, A Barhoum, YS Chan, A Dufresne, and MK Danquah, “Review on nanoparticles and nanostructured materials: History, sources, toxicity and regulations,” Beilstein Journal of Nanotechnology, vol. 9, no. 1, pp. 1050–1074, 2018, doi: 10.3762/bjnano.9.98.
3. DF Emerich and CG Thanos, “Nanotechnology and medicine,” pp. 655–663, 2003.
4. X Shan, X Gong, J Li, J Wen, Y Li, and Z Zhang, “Current approaches of nanomedicines in the market and various stage of clinical translation,” Acta Pharm Sin B, vol. 12, no. 7, pp. 3028–3048, 2022, doi: 10.1016/J.APSB.2022.02.025.
5. D Schaming and H Remita, “Nanotechnology: from the ancient time to nowadays,” Found Chem, vol. 17, no. 3, pp. 187–205, 2015, doi: 10.1007/s10698-015-9235-y.
6. R Morones Ramírez, “Plata, Metal Precioso.” https://www.cyd.conacyt.gob.mx/archivo/241/Articulos/Plata/Plata5.html (accessed Oct. 06, 2021).
7. D Schaming and H Remita, “Nanotechnology: from the ancient time to nowadays,” Found Chem, vol. 17, no. 3, pp. 187–205, 2015, doi: 10.1007/s10698-015-9235-y.
8. M Gómez-Garzón, “Nanomateriales, Nanopartículas y Síntesis verde,” Revista Repertorio de Medicina y Cirugía, vol. 27, no. 2, pp. 75–80, 2018, doi: 10.31260/repertmedcir.v27.n2.2018.191.
9. JT Seil and TJ Webster, “Antimicrobial applications of nanotechnology: methods and literature,” International Journal of Nanomedicine Dovepress, vol. 7, pp. 2767–2781, 2012, doi: 10.2147/IJN.S24805.
10. I Berlanga Mora, “Síntesis y caracterización de nanomateriales 0D, 1D y 2D,” Universidad Autónoma de Madrid, Madrid, 2013. Accessed: Oct. 07, 2021. [Online]. Available: https://repositorio.uam.es/bitstream/handle/10486/660464/berlanga_mora_isadora.pdf?sequence=1
11. H Huang, J Lai, J Lu, and Z Li, “Pulsed laser ablation of bulk target and particle products in liquid for nanomaterial fabrication,” AIP Adv, vol. 9, no. 1, p. 015307, 2019, doi: 10.1063/1.5082695.
12. D Zhang, B Gökce, and S Barcikowski, “Laser Synthesis and Processing of Colloids: Fundamentals and Applications,” Chem Rev, vol. 117, no. 5, pp. 3990–4103, 2017, doi: 10.1021/ACS.CHEMREV.6B00468/ASSET/IMAGES/MEDIUM/CR-2016-00468N_0092.GIF.
13. S. O. F. Nanoparticles, T. Application, and I. N. Animal, “Síntesis de nanopartículas y su aplicación en la nutrición animal,” AGROPRODUCTIVIDAD, vol. 11, pp. 85–90, 2018.
14. M Hernández Díaz, “Síntesis de nanopartículas de plata biológicamente asisitida con opontia SP. y su incorporación en membranas poliméricas nanofibrosas,” Centro de Investigación en Química Aplicada, Saltillo, Coahuila, 2013. Accessed: Sep. 30, 2021. [Online]. Available: https://ciqa.repositorioinstitucional.mx/jspui/bitstream/1025/64/1/Tesis%20de%20maestria%20Marco%20Polo%20Hernadez.pdf
15. A Roy et al., “Biological synthesis of nanocatalysts and their applications,” Catalysts, vol. 11, no. 12. MDPI, 2021. doi: 10.3390/catal11121494.
16. M Jeyaraj, S Gurunathan, M Qasim, MH Kang, and JH Kim, “A comprehensive review on the synthesis, characterization, and biomedical application of platinum nanoparticles,” Nanomaterials, vol. 9, no. 12. MDPI AG, 2019. doi: 10.3390/nano9121719.
17. N Malatesti et al., “Synthesis, characterisation and in vitro investigation of photodynamic activity of 5-(4-octadecanamidophenyl)-10,15,20-tris(N-methylpyridinium-3-yl)porphyrin trichloride on HeLa cells using low light fluence rate,” Photodiagnosis Photodyn Ther, vol. 15, pp. 115–126, 2016, doi: 10.1016/j.pdpdt.2016.07.003.
18. G Chen, I Roy, C Yang, and PN Prasad, “Nanochemistry and Nanomedicine for Nanoparticle-based Diagnostics and Therapy,” Chem Rev, vol. 116, no. 5, pp. 2826–2885, 2016, doi: 10.1021/acs.chemrev.5b00148.
19. T Başoğlu et al., “Valor predictivo de los índices 18F-FDG PET/TC sobre la carga tumoral residual en pacientes con cáncer de mama extenso tratadas con quimioterapia neoadyuvante,” Rev Esp Med Nucl Imagen Mol, vol. 41, no. 3, pp. 171–178, 2022, doi: 10.1016/J.REMN.2021.04.003.
20. R Ruiz-Villaverde, N Faro-Miguez, D Sánchez-Cano, and AJ Martín-Pérez, “Sarcoma de Kaposi clásico: más allá de la piel,” Rev Esp Geriatr Gerontol, vol. 56, no. 6, pp. 371–372, 2021, doi: 10.1016/J.REGG.2021.01.011.
21. B Yilmaz and O Ozay, “Synthesis of antibiotic-modified silica nanoparticles and their use as a controlled drug release system with antibacterial properties,” Phosphorus Sulfur Silicon Relat Elem, 2022, doi: 10.1080/10426507.2022.2049267.
22. H Bronstein, CB Nielsen, BC Schroeder, and I McCulloch, “The role of chemical design in the performance of organic semiconductors,” Nat Rev Chem, 2020, doi: 10.1038/s41570-019-0152-9.
23. JL Belmonte‐Vázquez et al., “Asymmetric Dual‐State Emitters Featuring Thiazole Acceptors,” European J Org Chem, 2022, doi: 10.1002/ejoc.202200372.
24. SL Estrada Flores, C Garcias-Morales, RSM Velázquez, CMP Berumen, and FN de La Cruz Duran, “An overview of Organic Electronics,” Educacion Quimica, vol. 33, no. 2, pp. 3–17, 2022, doi: 10.22201/fq.18708404e.2022.2.79879.
25. WM Sharman, CM Allen, and JE van Lier, “Photodynamic therapeutics: Basic principles and clinical applications,” Drug Discov Today, vol. 4, no. 11, pp. 507–517, 1999, doi: 10.1016/S1359-6446(99)01412-9.
26. A Kano, Y Taniwaki, I Nakamura, N Shimada, K Moriyama, and A Maruyama, “Tumor delivery of Photofrin® by PLL-g-PEG for photodynamic therapy,” Journal of Controlled Release, vol. 167, no. 3, pp. 315–321, 2013, doi: 10.1016/j.jconrel.2013.02.016.
27. R Taoka et al., “Photodynamic diagnosis-assisted transurethral resection using oral 5-aminolevulinic acid decreases residual cancer and improves recurrence-free survival in patients with non-muscle-invasive bladder cancer,” Photodiagnosis Photodyn Ther, vol. 38, p. 102838, 2022, doi: 10.1016/J.PDPDT.2022.102838.
28. A S. Ries et al., “Water-soluble tetra-cationic porphyrins display virucidal activity against Bovine adenovirus and Bovine alphaherpesvirus 1,” Photodiagnosis Photodyn Ther, vol. 31, p. 101947, 2020, doi: 10.1016/J.PDPDT.2020.101947.
29. R Liu, Y Gao, N Liu, and Y Suo, “Nanoparticles loading porphyrin sensitizers in improvement of photodynamic therapy for ovarian cancer,” Photodiagnosis Photodyn Ther, vol. 33, p. 102156, 2021, doi: 10.1016/J.PDPDT.2020.102156.
30. KADF Castro et al., “Comparison of the Photodynamic Action of Porphyrin, Chlorin, and Isobacteriochlorin Derivatives toward a Melanotic Cell Line,” ACS Appl Bio Mater, vol. 4, no. 6, pp. 4925–4935, 2021, doi: 10.1021/acsabm.1c00218.
31. PG Calzavara-Pinton, M Venturini, and R Sala, “Photodynamic therapy: Update 2006 Part 1: Photochemistry and photobiology,” Journal of the European Academy of Dermatology and Venereology, vol. 21, no. 3. pp. 293–302, 2007. doi: 10.1111/j.1468-3083.2006.01902.x.
32. JM Keca and G Zheng, “Texaphyrin: From molecule to nanoparticle,” Coord Chem Rev, vol. 379, pp. 133–146, 2019, doi: 10.1016/J.CCR.2017.08.026.
33. KW Woodburn et al., “Phototherapy of Cancer and Atheromatous Plaque with Texaphyrins,” Mary Ann Liebert, Inc, 1996. [Online]. Available: www.liebertpub.com
34. A Rück, A Böhmler, and R Steiner, “PDT with TOOKAD® studied in the chorioallantoic membrane of fertilized eggs,” Photodiagnosis Photodyn Ther, vol. 2, no. 1 SPEC. ISS., pp. 79–90, 2005, doi: 10.1016/S1572-1000(05)00006-2.
35. LB Josefsen and RW Boyle, “Photodynamic therapy and the development of metal-based photosensitisers,” Metal-Based Drugs, vol. 2008. 2008. doi: 10.1155/2008/276109.
36. L Aparicio-Ixta et al., “Two-photon excited fluorescence of silica nanoparticles loaded with a fluorene-based monomer and its cross-conjugated polymer: Their application to cell imaging,” Nanoscale, vol. 4, no. 24, pp. 7751–7759, 2012, doi: 10.1039/C2NR31925J.
37. “Terapia fotodinámica.” https://www.cancer.org/es/tratamiento/tratamientos-y-efectos-secundarios/tipos-de-tratamiento/radioterapia/terapia-fotodinamica.html (accessed Apr. 28, 2022).
38. G Li et al., “High-efficiency solution processable polymer photovoltaic cells by self-organization of polymer blends,” Nat Mater, vol. 4, no. 11, pp. 864–868, 2005, doi: 10.1038/nmat1500.
39. Z Yang et al., “Rational design and facile preparation of maleimide-based functional materials for imaging and optoelectronic applications,” Mater Chem Front, vol. 3, no. 4, pp. 571–578, 2019, doi: 10.1039/c8qm00559a.
40. S Yao et al., “Donor-acceptor-donor fluorene derivatives for two-photon fluorescence lysosomal imaging,” Journal of Organic Chemistry, vol. 75, no. 12, pp. 3965–3974, 2010, doi: 10.1021/jo100554j.
41. Y Huang, F Hu, R Zhao, G Zhang, H Yang, and D Zhang, “Tetraphenylethylene conjugated with a specific peptide as a fluorescence turn-on bioprobe for the highly specific detection and tracing of tumor markers in live cancer cells,” Chemistry - A European Journal, vol. 20, no. 1, pp. 158–164, 2014, doi: 10.1002/chem.201303679.
42. Z Magdolenova, AR Collins, A Kumar, A Dhawam, V Stone, and M Dusinska, “Mechanisms of Genotoxicity . Review of Recent in vitro and in vivo Studies with Engineered Nanoparticles Mechanisms of genotoxicity . A review of in vitro and in vivo studies with engineered nanoparticles,” 2013, doi: 10.3109/17435390.2013.773464.
43. LS Tanaka, “Regulando la nanotecnología Regulating nanotechnology,” vol. 12, no. 22, 2019.
44. AD Maynard and RJ Aitken, “Assessing exposure to airborne nanomaterials: Current abilities and future requirements,” Nanotoxicology, vol. 1, no. 1, pp. 26–41, 2007, doi: 10.1080/17435390701314720.
45. “Las nanotecnologías en el CENAM | Centro Nacional de Metrología | Gobierno | gob.mx.” https://www.gob.mx/cenam/articulos/las-nanotecnologia-en-el-cenam (accessed Feb. 10, 2022).
46. W Lojkowski et al., “Nanometrology,” 2006. [Online]. Available: http://www.unipress.waw.plhttp://www.physics.metu.edu.tr/smd/turan/http://www.inmat.pw.edu.plhttp://www.ifpan.edu.plhttp://cluster.phys.uni-sofia.bg/anap/http://www.phys.put.poznan.pl/http://uranos.cto.us.edu.pl/~physics/pl/
47. LJ Johnston, N Gonzalez-Rojano, KJ Wilkinson, and B Xing, “Key challenges for evaluation of the safety of engineered nanomaterials,” NanoImpact, vol. 18, 2020, doi: 10.1016/j.impact.2020.100219.
48. LJ Johnston, N Gonzalez-Rojano, KJ Wilkinson, and B Xing, “Hed Challenges for Evaluation of the Safety of Engineered Nanomaterials.” [Online]. Available: https://iupac.org/project/2016-045-2-700
49. ZN Amaris, DN Freitas, K Mac, KT Gerner, C Nameth, and KE Wheeler, “Nanoparticle Synthesis, Characterization, and Ecotoxicity: A Research-Based Set of Laboratory Experiments for a General Chemistry Course,” J Chem Educ, vol. 94, no. 12, pp. 1939–1945, 2017, doi: 10.1021/acs.jchemed.7b00369.
50. LS Tanaka, “Regulación blanda, normas técnicas y armonización regulatoria internacional, para la nanotecnología,” Mundo Nano. Revista Interdisciplinaria en Nanociencias y Nanotecnología, vol. 13, no. 24, pp. 1e–27e, 2020, doi: 10.22201/CEIICH.24485691E.2020.24.69621.
|
Revista QuímicaViva Número 1, año 22, Abril 2023 quimicaviva@qb.fcen.uba.ar |