Estudio mediante Espectroscopía Infrarroja de bioderivados de Pleurotus ostreatus (CCEBI-3024)
Yamila Lebeque-Pérez1![]() ,
Armando Ferrer-Serrano2*
,
Armando Ferrer-Serrano2*![]() ,
Manuel de Jesús Serrat-Díaz1
,
Manuel de Jesús Serrat-Díaz1![]() ,
Gabriel Llauradó-Maury3
,
Gabriel Llauradó-Maury3![]() ,
Daily Arias Ramos4
,
Daily Arias Ramos4![]() .
.
1 Centro de Estudios de Biotecnología Industrial. Universidad de Oriente, Santiago de Cuba, Cuba.
2 Departamento de Química. Facultad de Ciencias Naturales y Exactas. Universidad de Oriente. Santiago de Cuba, Cuba.
3 Laboratorio de Microbiología, Parasitología e Higiene (LMPH), Departamento de Ciencias Farmacéuticas, Facultad de Ciencias Farmacéuticas, Biomédicas y Veterinarias, Universidad de Amberes, Bélgica.
4 Departamento de Farmacia. Facultad de Ciencias Naturales y Exactas. Universidad de Oriente. Santiago de Cuba, Cuba.
Recibido: 14/08/2023 - Aceptado: 25/08/2023
Resumen
Los compuestos bioactivos de fuentes naturales, resultan atractivos para la industria biomédicofarmacéutica por sus aplicaciones inmunonutricionales. Los hongos comestibles-medicinales constituyen una fuente escasamente explorada por su potencial prebiótico, aunque sus polisacáridos son muy valorados en el estudio de tratamientos para las inmunodeficiencias. El objetivo fue caracterizar, mediante Espectroscopía Infrarroja con transformada de Fourier (FT-IR), bioderivados de Pleurotus ostreatus (CCEBI-3024). Se obtuvieron bioderivados, a partir de la biomasa del micelio y de cuerpos fructíferos, según procedimientos del Centro de Estudios de Biotecnología Industrial (CEBI). Se caracterizó por FT-IR y con el programa Spartan 08 se realizó la modelación predictiva de un polisacárido típico encontrado en hongos. El extracto (ECf-P) y el extracto de polvo (EBSCf-P) de cuerpos fructíferos revelaron espectros similares con señales de grupos funcionales que sugieren la presencia de polisacáridos. El extracto (EMP) y extracto de polvo (EBSM-P) de micelio, igualmente, mostraron señales similares para este tipo de biomolécula. Este estudio no resulta concluyente, pero indica la presencia de grupos funcionales de interés y constituye el precedente para la confirmación de la presencia de estructuras con potencial prebiótico.
Palabras clave: Pleurotus ostreatus, Inmunonutrición, Prebióticos, Polisacáridos, Espectroscopía Infrarroja
Study using Infrared Spectroscopy of bioderivatives of Pleurotus ostreatus (CCEBI-3024)
Summary
Bioactive compounds from natural sources are attractive to the biomedical-pharmaceutical industry for their immunonutritional applications. Edible-medicinal mushrooms constitute a source, scarcely explored for their prebiotic potential, although their polysaccharides are highly valued in the study of treatments for immunodeficiencies. The objective was to characterize, by means of Infrared Spectroscopy (FT-IR), bioderivatives of Pleurotus ostreatus (CCEBI-3024). Bioderivatives were obtained from the wet biomass of mycelium and from fruiting bodies, according to the procedures at the Study Center for Industrial Biotechnology (CEBI) and were characterized by FT-IR spectroscopy. The extract (ECf-P) and the powder extract (EBSCf-P) of fruiting bodies revealed similar spectra with signals indicating the presence of glucantype polysaccharides. The extract (EM-P) and the powder extract (EBSM-P) of mycelium, likewise, resulted with similar signals for this type of biomolecule. This study is not conclusive, but it indicates the presence of functional groups of interest and constitutes a precedent for the confirmation of their prebiotic potential.
Keywords: Pleurotus ostreatus, Immunonutrition, Prebiotics, Polysaccharides, Infrared Spectroscopy
Introducción
En los últimos años, debido a los cambios significativos hacia estilos de vida más saludable, especialmente durante la pandemia de COVID-19, están en aumento las prácticas dietéticas de personas y consumidores que optan por suplementos que mejoran la inmunidad, y por alimentos funcionales y nutracéuticos a base de hongos [1].
Las biomoléculas de los hongos han atraído la atención de investigadores de todo el mundo debido a sus atributos saludables comprobados [2]. Los hongos están dotados de actividades antioxidantes, antimicrobianas, anticancerígenas, prebióticas, antidiabéticas y antiinflamatorias, manteniendo un gran potencial terapéutico y un amplio espectro de aplicaciones clínicas. Se ha informado una amplia gama de compuestos bioactivos que incluyen polisacáridos, complejos proteínas-polisacáridos, péptidos y proteínas, terpenoides y compuestos fenólicos en diversos grupos de hongos [1]. Los polisacáridos son polímeros naturales que están presentes, ampliamente, en plantas, animales y microorganismos. Sus propiedades físico-químicas, químicas y biológicas dependen de la estructura [3]. Los polisacáridos son macromoléculas naturales constituidas por una cadena lineal o ramificada de enlaces glucosídicos de más de 10 monosacáridos, cuyo rango de masa molecular va de decenas de miles a millones de Dalton [4].
La investigación, tanto de la estructura como de los efectos fisiológicos de los polisacáridos, recibe cada vez más atención. La estructura primaria, por ejemplo, la composición, el patrón de enlaces y la secuencia de los monosacáridos, pueden tener un impacto significativo en la bioactividad. Estudios previos han demostrado que los polisacáridos juegan un papel vital en la vida de los organismos vivos. Por ejemplo, los polisacáridos de hongos comestibles y medicinales tienen aplicación potencial como modificadores de la respuesta biológica (BRM, por sus siglas en inglés) [2].
Las especies de Pleurotus se han utilizado como medicinales desde hace mucho tiempo, ya que contienen diversos compuestos con propiedades farmacológicas y nutracéuticas beneficiosas. Tales sustancias son lectinas con actividades inmunomoduladoras, antiproliferativas y antitumorales; compuestos fenólicos con actividad antioxidante; y polisacáridos (polisacaropéptidos y glicoproteínas) con actividades inmunopotenciadoras y anticancerígenas [4].
Los β-glucanos son una familia de polisacáridos con estructura química heterogénea [5]. Se sabe que los betaglucanos son polímeros de glucosa que muestran, generalmente, efectos positivos en la salud humana. Estos se encuentran en bacterias, hongos, levaduras y plantas [6].
Se cree que la estructura primaria, el grado de ramificación, el peso molecular y la solubilidad, así como la carga de los polímeros, influyen en la actividad biológica. Varias bioactividades fundamentales, se informan en la literatura y se describen para aplicaciones futuras. Especialmente los efectos inmunomoduladores son de interés y se anuncian en numerosos productos complementarios alimentarios que contienen β-glucanos o extractos que contienen β-glucanos, de algas, levaduras y hongos [6].
Muy pocas investigaciones se han centrado en polisacáridos complejos, de cadena larga, no digeribles con potencial como nuevos prebióticos. Los beta-glucanos que existen como polisacáridos no digeribles, derivados de diferentes fuentes de alimentos, han demostrado no solo efectos que promueven la salud, sino también el potencial como fuente novedosa de prebióticos [7]. Los prebióticos fueron definidos por Gibson y Roberfroid (1995) [8] como “ingredientes alimentarios no digeribles que afectan beneficiosamente al huésped al estimular selectivamente el crecimiento y/o la actividad de una o un número limitado de bacterias en el colon”. Recientemente, los carbohidratos bioactivos, complejos de cadena larga (polisacáridos) de cereales, hongos, hierbas y raíces, están ganando atención como nuevas alternativas prebióticas [7].
La Espectroscopía Infrarroja con transformada de Fourier (FT-IR), es una técnica de análisis químico cualitativo que permite identificar los grupos funcionales de los compuestos orgánicos, donde la muestra es sometida a irradiación infrarroja con la herramienta de Reflectancia Total Atenuada (ATR). Esta permite el análisis de la muestra sin ser sometida a tratamientos previos, lo cual favorece que no se incorpore ninguna sustancia que interfiera en los resultados [9].
Teniendo en cuenta los planteamientos anteriores, el objetivo de este trabajo fue caracterizar, mediante FT-IR, la composición de cuatro bioderivados de la seta comestible-medicinal Pleurotus ostreatus, con vistas a evaluar su potencial como prebiótico para futuras aplicaciones inmunonutricionales.
Materiales y Métodos
Material biológico y métodos de obtención de la biomasa de P. ostreatus y sus bioderivados.
Se utilizó la cepa de P. ostreatus (CCEBI-3024) de la Colección de Cultivos Microbianos del Centro de Estudios de Biotecnología Industrial (CEBI). Para la obtención de los bioderivados del micelio y cuerpos fructíferos, se partió de la biomasa producida por dos métodos de cultivos: la fermentación en estado sólido (FES) y la fermentación sumergida o líquida (FS). Según los procedimientos generales establecidos en el CEBI (Universidad de Oriente) para la obtención de preparados inmunocéuticos a partir de P. ostreatus con el empleo de la FES y la FS [10].
Cuerpos fructíferos de P. ostreatus:
Los cuerpos fructíferos se obtuvieron en la planta de producción de setas comestibles del CEBI. El ciclo productivo se desarrolló bajo condiciones de cultivo sanitarias, por la tecnología de fermentación en estado sólido (FES), sobre sustrato pulpa de café [11].
Micelio de P. ostreatus:
Se usaron placas Petri, con un crecimiento micelial total, del cuarto de colonización y cultivo del CEBI. Para el cultivo en FS, se tomó una porción del micelio de las placas y se inoculó a frascos de cultivo conteniendo medio extracto de levadura, los cuales se incubaron a 22 ⁰C con agitación (120 rpm) en zaranda (HDL, China) durante 10 días. La biomasa obtenida fue separada del medio de cultivo por filtración, lavada con agua destilada estéril, escurrida y pesada en balanza digital (Scout Pro, SPUt23, China) [12].
Extractos hidrosolubles de cuerpos fructíferos (ECf-P) y Micelio (EM-P):
Los extractos hidrosolubles fueron obtenidos según los procedimientos descritos por Llauradó et al. (2021) [13] y Lebeque et al. (2022) [12].
Extractos hidrosolubles de la Biomasa seca y pulverizada de cuerpos fructíferos (EBSCf-P):
Una vez cosechados, los cuerpos fructíferos se fragmentaron en trozos pequeños e incubaron en estufa durante 24 h a 45ºC para lograr su secado, y a continuación se realizó el molinado de los mismos (Retsch, GM 200, Alemania) [10,14]. El polvo resultante se conservó en bolsas de plástico. Posteriormente, se obtuvo una fracción acuosa a partir de 2,5 g de polvo resuspendidos en 25 mL de agua y en tubos Falcon de volumen 50 mL, sumergidos en baño termostático a 100ºC durante 6 horas. El resultado fue centrifugado en centrífuga (HealForce®, Neofuge 15, China) a 5500 rpm x 1h x 20ºC. Se separó el sobrenadante y se repitió (5 veces) el proceso de extracción a partir del precipitado y se colectaron y mezclaron todos los sobrenadantes. La mezcla se centrifugó, liofilizó y conservó en tubo de plástico, protegido de la luz y la humedad hasta su utilización.
Extractos hidrosolubles de la Biomasa seca y pulverizada del micelio (EBSM-P):
La biomasa micelial también se procesó según el mismo procedimiento descrito para la biomasa de cuerpos fructíferos (BCf-P), hasta obtener el liofilizado.
Caracterización por espectroscopía infrarroja.
Los espectros infrarrojos por transformada de Fourier (FT-IR) de las 4 muestras de P. ostreatus (extracto hidrosoluble EM-P y extracto hidrosoluble de biomasa seca pulverizada EBSM-P; extracto hidrosoluble ECf-P y extracto hidrosoluble del polvo seco EBSCf-P), tanto de cuerpos fructíferos como de micelio, fueron obtenidos a través de un espectrofotómetro JASCO 4000 (Japón) con Reflectancia Total Atenuada (ATR, por sus siglas en inglés). La data espectral fue procesada con el programa Spectra Manager JASCO (Japón). La predicción aproximada de los espectros IR fue realizada mediante el programa Spartan 08 [15].
Resultados y Discusión
Obtención de los bioderivados de P. ostreatus.
Los extractos hidrosolubles del micelio (EM-P) y cuerpos fructíferos (ECf-P) de P. ostreatus (CCEBI-3024) utilizados en este estudio, fueron obtenidos a partir de la biomasa húmeda (figura 1 a y b), de cada fase de crecimiento de la seta y liofilizados para su conservación. Los mismos, exhibieron la calidad requerida de acuerdo con los procedimientos de obtención establecidos y en correspondencia con los resultados informados por Lebeque et al. (2022) [12] lo que permitió disponer del material adecuado para los estudios realizados.

Figura 1: Biomasa húmeda de P. ostreatus (CCEBI-3024) obtenida por FES y FS. (a): cuerpos fructíferos. (b): masa micelial.
En el caso de los pulverizados de biomasa seca, igualmente se corresponden con materiales con características organolépticas aceptables para la especie. Resultados similares son presentados por Lebeque et al. (2018) [14] en un polvo de cuerpos fructíferos de P. ostreatus (figura 2, a y b). Así mismo, los extractos obtenidos a partir de los polvos (EBSCf-P y EBSM-P) fueron adecuados para los estudios realizados.

Figura 2: Biomasa seca de P. ostreatus (CCEBI-3024). (a): cuerpos fructíferos secos. (b): biomasa seca pulverizada de cuerpos fructíferos.
Exploración espectroscópica de extractos hidrosolubles y biomasas secas pulverizadas de P. ostreatus.
Se registraron los espectros FT-IR de 4 muestras de P. ostreatus (CCEBI-3024) (pulverizados secos y extractos hidrosolubles), tanto de cuerpos fructíferos como del micelio, característicos para los gruposfuncionales de los metabolitos presentes en los bioderivados. Los espectros de los bioderivados del micelio se muestran a continuación en la figura 3 (a y b):
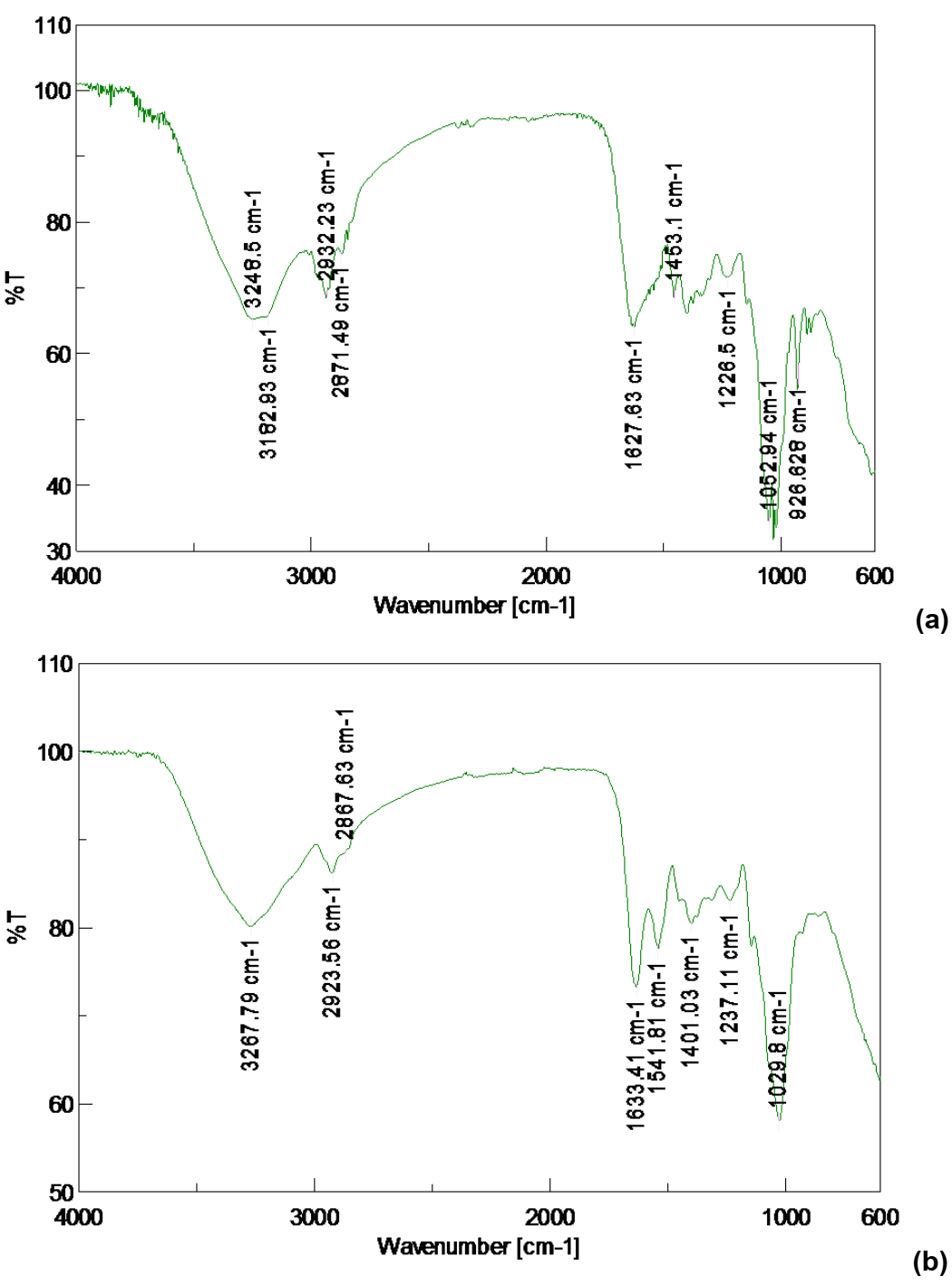
Figura 3: Espectros FT/IR obtenidos para bioderivados del micelio de P. ostreatus (CCEBI-3024). (a): extracto hidrosoluble EM-P y (b): extracto hidrosoluble de pulverizado EBSM-P.
En estas primeras muestras fue posible notar gran similitud entre los espectros de extracto EM-P y extracto hidrosoluble de polvo seco EBSM-P, en cuanto a posición, forma e intensidad de las bandas. Esto hace pensar en composiciones químicas semejantes en ambas muestras. Se pudieron hallar señales centradas en 3248 y 3182 cm-1 para extracto y 3267 cm-1 para extracto de polvo, correspondientes a vibraciones de grupos OH, que abundan en polisacáridos, beta glucanos y monosacáridos.
También en 2932 cm-1 para extracto y 2923 cm-1 para extracto de polvo, es posible notar una banda correspondiente a grupos CH alifáticos. Entre 1000 y 1300 cm-1 se distinguen varias bandas que pueden asociarse, entre otras posibilidades, a vibraciones C-O, muy comunes en polisacáridos [16]. Sin embargo, destacan otras señales distintivas como 1627 cm-1 (en EM-P) y 1633 cm-1 (en EBSM-P), que pueden asociarse a la presencia de grupos carbonilo, de varios tipos de metabolitos, pero en especial de azúcares reductores [16]. Resulta interesante ver algunas bandas que pueden asociarse a la presencia de anillos aromáticos, pero que suelen confundirse con vibraciones de doblaje de carbonos alifáticos con sus respectivos hidrógenos. Las tablas siguientes (tabla I, a y b), muestran un resumen de las principales señales encontradas en ambos espectros.
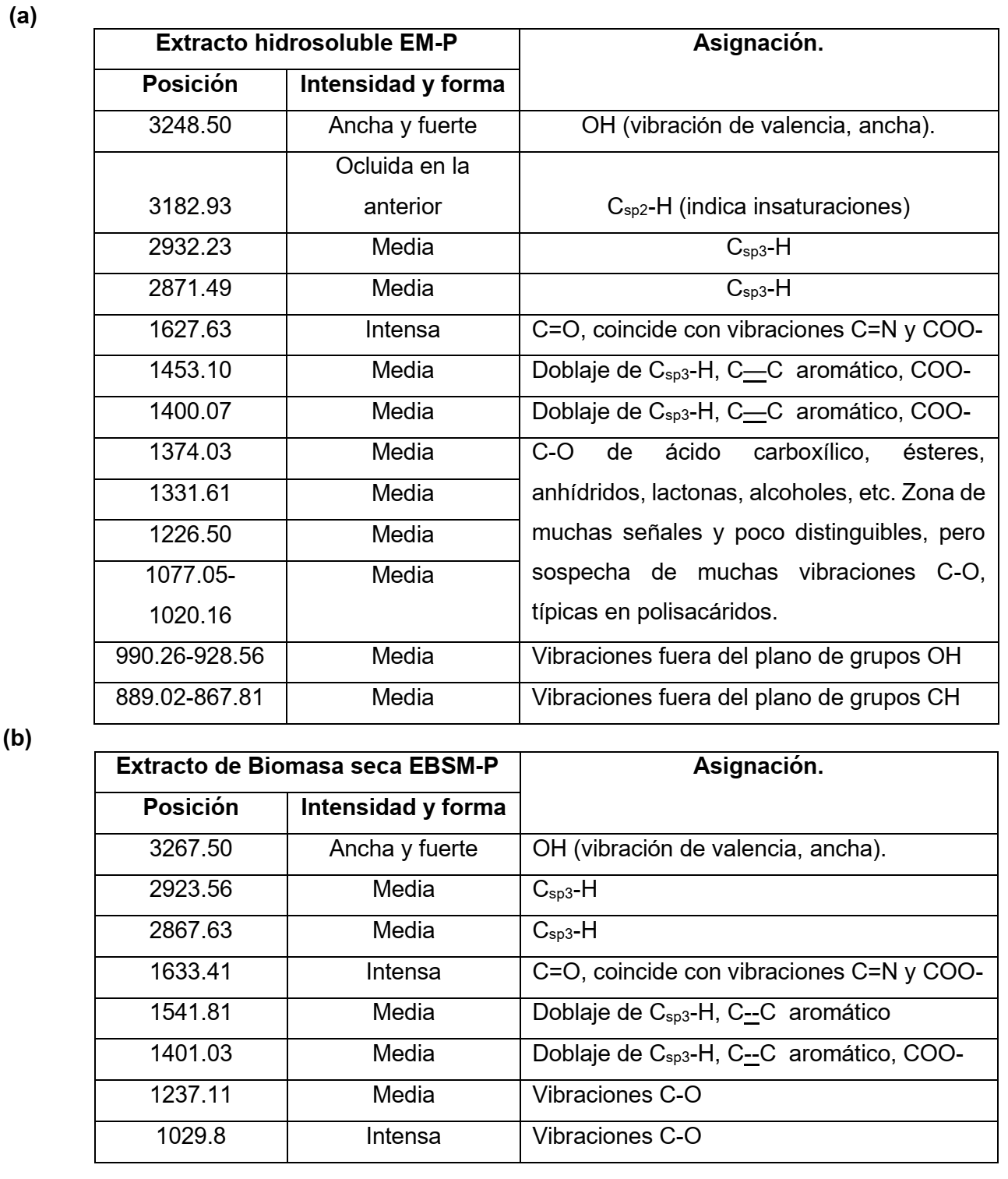
Tabla I: Principales señales de los espectros IR del extracto hidrosoluble y del extracto del polvo seco del micelio de P. ostreatus (CCEBI-3024) [16]
En el caso de los cuerpos frutíferos, sucede de manera semejante. Los espectros de ambas muestras (ECfP y EBSCf-P) tienen grandes semejanzas en cuanto a forma y posición de las señales, lo que hace sospechar acerca de composiciones químicas similares, al menos cualitativamente (figura 4, a y b). El análisis resulta muy parecido al anterior, pues las posiciones de las bandas son semejantes a lo observado con el micelio.
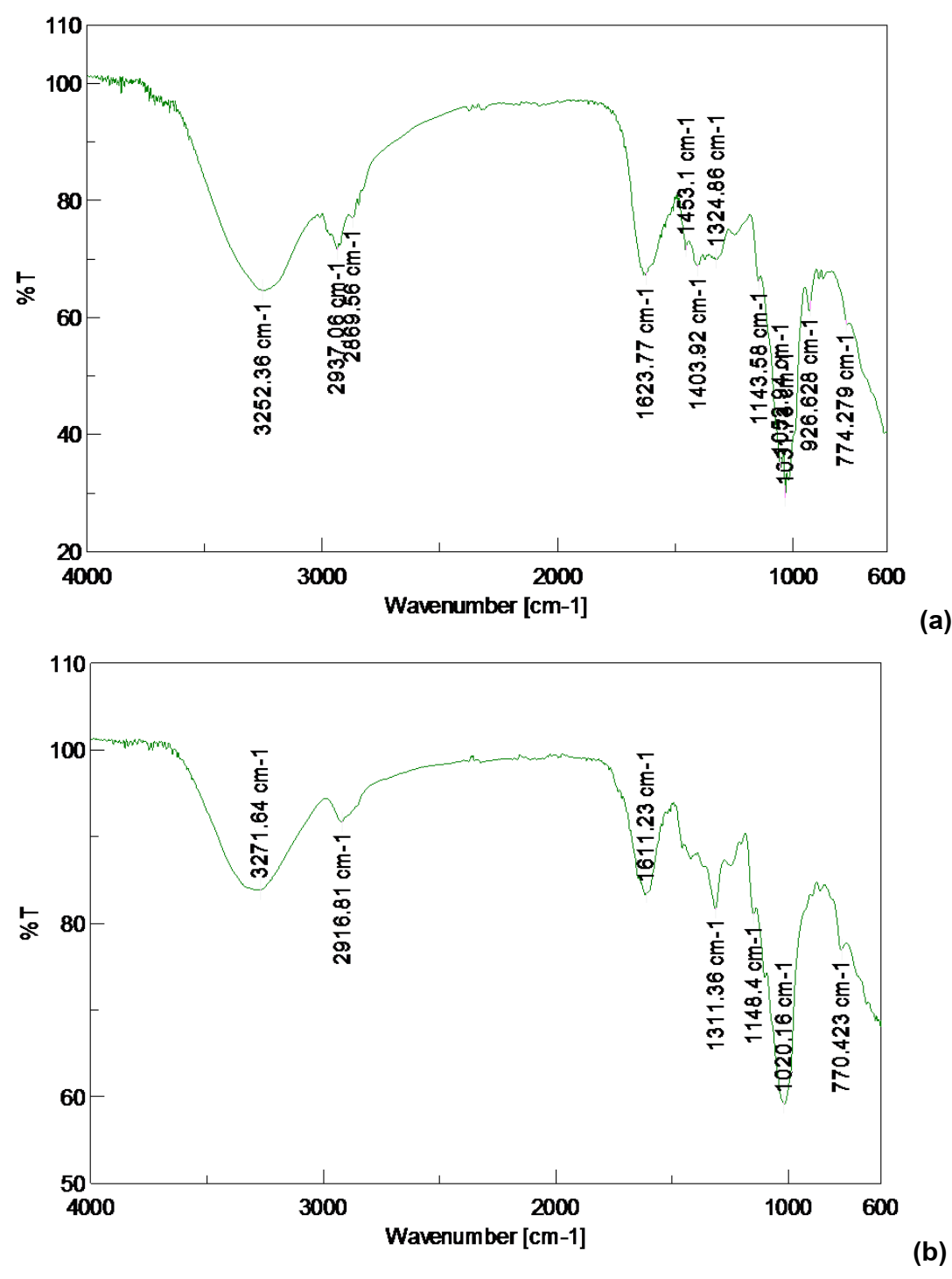
Figura 4: Espectros FT/IR obtenidos para bioderivados de cuerpos fructíferos de P. ostreatus (CCEBI-3024) (a): extracto hidrosoluble ECf-P y (b) extracto del polvo seco EBSCf-P.
La tabla II (a y b), muestra un resumen de las principales señales encontradas en los espectros obtenidos para bioderivados extracto ECf-P y extracto de polvo seco EBSCf-P de cuerpos fructíferos de P. ostreatus (CCEBI-3024).
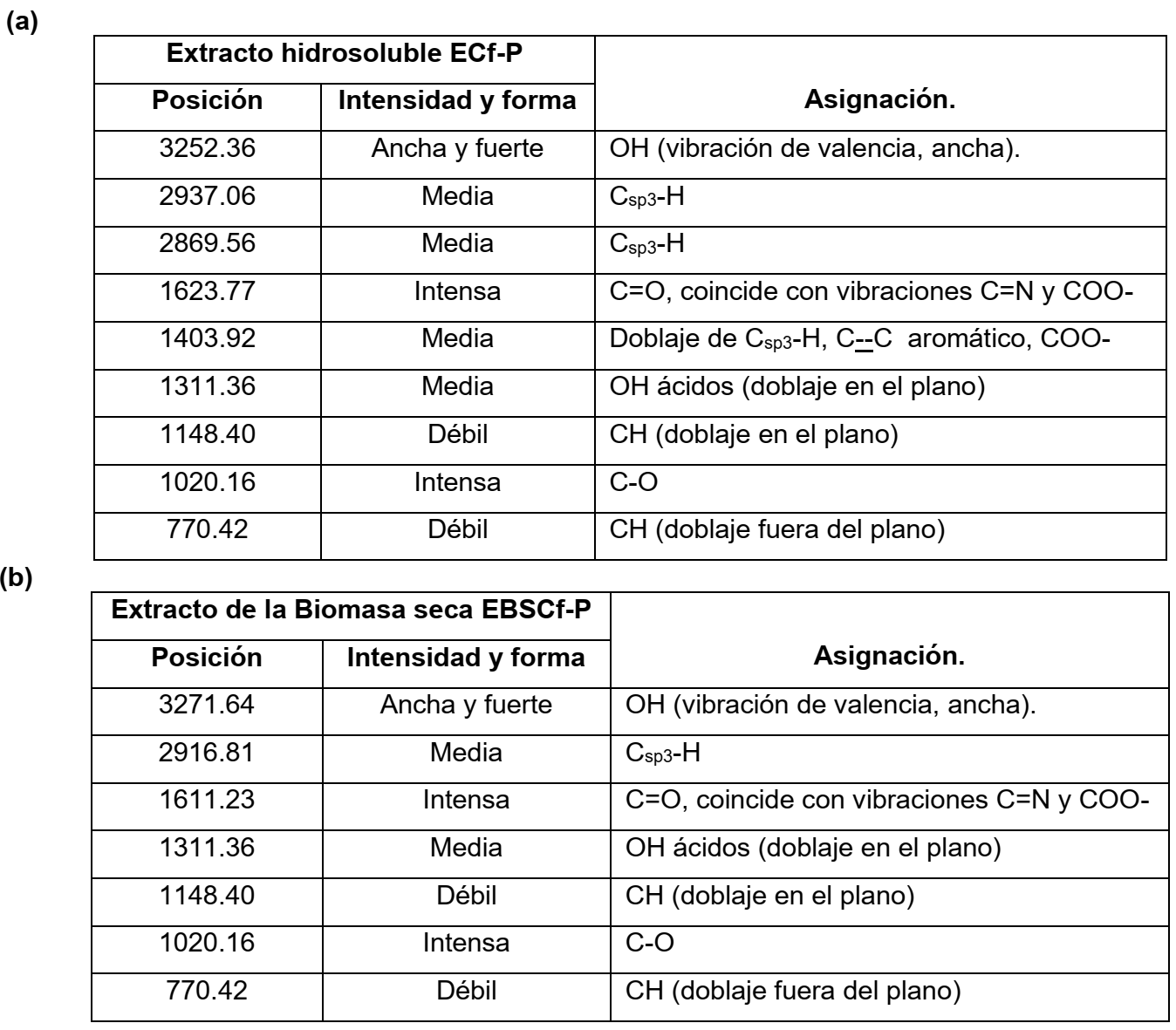
Tabla II: Principales señales de los espectros IR del extracto hidrosoluble y del extracto de la biomasa seca pulverizada de cuerpos fructíferos de P. ostreatus (CCEBI-3024) [16].
En esencia, estos espectros de Pleurotus muestran la presencia de grupos funcionales, comunmente presentes en polisacáridos, glicósidos, azúcares reductores, entre otros, descritos en la bibliografía [16]. Esto no está en contradicción con otras fuentes, que indican que los polisacáridos tienden a ser los metabolitos más detectados en esta clase de hongos [18]. Una revisión bibliográfica sobre espectros FTIR de polisacáridos y β-glucanos, indican grandes similitudes con los espectros obtenidos en esta investigación [19]. De la misma manera, estudios recientes muestran que las señales más distintivas de polisacáridos de esta naturaleza, son las relacionadas con los grupos hidroxilos y agrupaciones carbonooxígeno [3,20] (tabla III). Por lo que las principales asignaciones citadas son: picos alrededor de 3400 cm-1 debido a la presencia de modos de vibración de valencia de grupos hidroxilo; las señales alrededor de 2929-2936 cm-1, ciertamente indican la presencia de articulaciones de carbonos sp3 con H de azúcares. Las bandas entre 1200 y 1500 cm-1 se deben, fundamentalmente, a agrupaciones C-O-H. Así mismo la banda de 1040 cm-1 se corresponde a vibraciones de valencia tipo C-O-C.
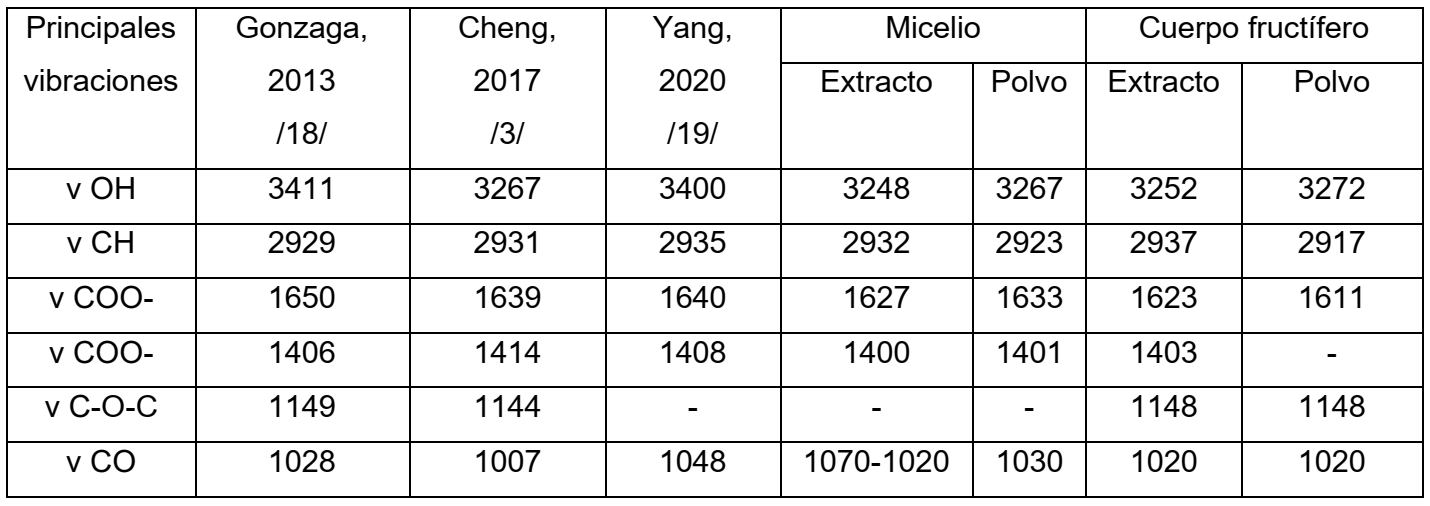
Tabla III: Comparación de señales de espectros IR reportadas en la literatura, para crudos de polisacáridos extraídos de hongos, con las obtenidas para P. ostreatus (CCEBI-3024) en este estudio.
Predicción del espectro IR de un polisacárido típico de hongos.
Por otro lado, las herramientas computacionales ofrecen un apoyo importante, no solo para conocer las disposiciones espaciales de los átomos, sino también para predecir espectros, en especial, infrarrojos. Se modeló un polisacárido típico encontrado en hongos y levaduras, el cual contiene unidades de glucosa unidas por las posiciones 1,3 y con ramificaciones en la posición 1,6 [21] (Figura 5).
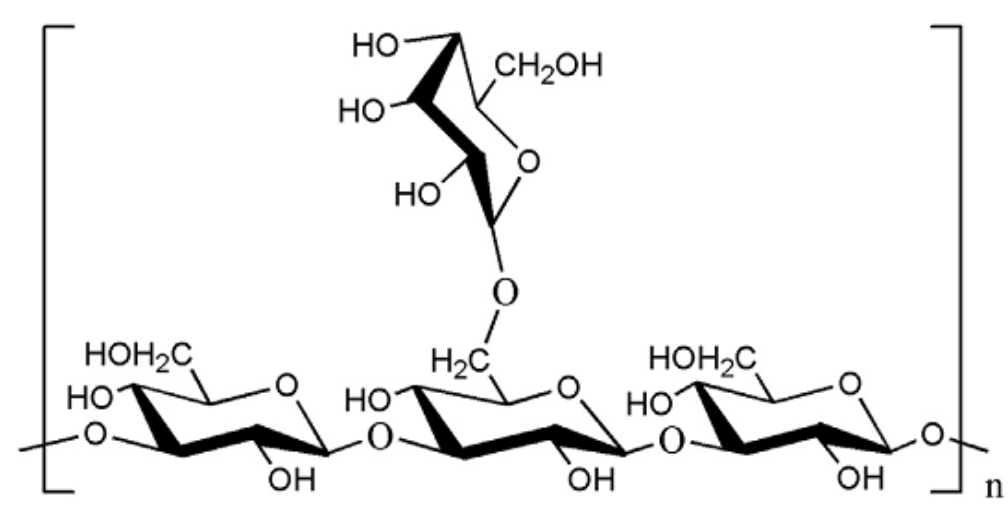
Figura 5: Estructura de β-(1,3)-(1,6)-glucano de hongos y levaduras.[20]
Se utilizó el programa Spartan 08, realizando una pre-optimización de la estructura, mediante la determinación de su energía mínima y calculando el espectro IR con un método semi-empírico AM1. El resultado se muestra en la figura 6, donde se observa un espectro con señales coincidentes con las experimentales. De esta manera, es posible comprobar que las dos señales distintivas que aparecen tanto en la predicción como en lo experimental, se corresponden con vibraciones OH (3470 y 3430 cm-1) y carbonos sp3 con hidrógenos (3000-2980 cm-1). El resto de las bandas se corresponden con vibraciones de valencia de agrupaciones C-O-C o C-O de las uniones entre sacáridos (ver Figura 5) y de doblaje en el plano y fuera del plano de osciladores como CH, OH, COH, entre otras.
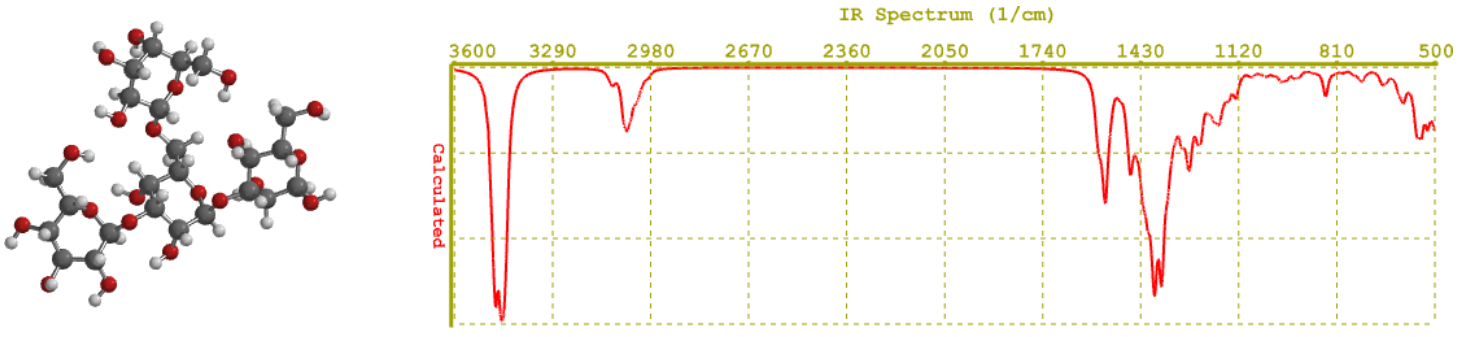
Figura 6: Espectros IR de la estructura de un β-(1,3)-(1,6)-glucano fúngico, calculados mediante el programa Spartan 08, en su versión para Windows, a través de un método semiempírico AM1.
A partir de la modelación, se puede inferir que las señales encontradas experimentalmente, en extractos de biomasas del micelio y cuerpos fructíferos de P. ostreatus (CCEBI-3024), se corresponden con la presencia de carbohidratos encontrados en bioderivados similares de la especie [12,13]. Y teóricamente, podrían contener polisacáridos de tipo β-(1,3)-(1,6)-glucano, similar a lo reportado por Lebeque et al. (2018) [14]. Sin embargo, se conoce la existencia también de otros metabolitos, tales como fenoles [14], así como, triterpenos, quinonas y flavonoides [10] en P. ostreatus (CCEBI-3024) y polifenoles y terpenos en otras especies de Pleurotus [22] cuyas señales, probablemente, aparecen en los espectros experimentales.
Conclusiones
Este estudio mediante espectroscopía FT-IR de extractos hidrosolubles y extractos hidrosolubles de polvos secos de la seta comestible-medicinal P. ostreatus, sugiere la presencia de polisacáridos, probablemente con forma de β-(1,3)-(1,6)-glucanos, entre otros metabolitos y en correspondencia con lo que plantea la bibliografía. Destaca la similitud observada entre espectros de extracto hidrosoluble y extracto de polvo seco de cuerpos fructíferos y de micelio. Por lo que es probable, encontrar el mismo tipo de estructuras para ambas formas de biopreparados.
El estudio espectroscópico por FT-IR, es indicativo de la presencia de grupos funcionales correspondientes a este tipo de compuestos en los bioderivados estudiados, soportado en este caso, por un estudio de predicción basado en modelación molecular.
Los resultados constituyen el precedente para la futura confirmación de estructuras químicas presentes en estos bioderivados con potencial prebiótico, por técnicas analíticas más potentes como la espectrometríade masas y la resonancia magnética nuclear, combinadas o no con métodos eficientes de fraccionamiento de macromoléculas.
Agradecimientos
Agradecemos al Ministerio Cubano de Ciencia Tecnología y Medio Ambiente (Proyecto Territorial PT241SC003-003) del Programa “Desarrollo de Productos y Servicios de Salud”. A la Cooperación Belga para el Desarrollo (Proyecto VLIR-UO, Consejo Interuniversitario Flamenco-Cooperación Universitaria para el Desarrollo), en el Programa de Cooperación Universitaria Institucional con la Universidad de Oriente. Así como al Grupo de Química Sostenible y Supramolecular de la Universitat Jaume I, España.
Referencias:
1. Kour H, Kour D, Kour S, Singh S, Jawad SA, Yadav AN, Kumar K, Sharma YP, and Ahluwalia AS. (2022) Bioactive compounds from mushrooms: Emerging bioresources of food and nutraceuticals. Food Biociencies 50(Part B): 102-124. https://doi.org/10.1016/j.fbio.2022.102124
2. Prasad-Singh M, Nand-Rai S, Kumar-Dubey S, Tiwari-Pandey A, Tabassum N, Chaturvedi VK, and Bahadur NS. (2022) Biomolecules of mushroom: a recipe of human wellness. Critical Reviews in Biotechnology 42(6): 913-930. https://10.1080/07388551.2021.1964431
3. Chen L, Peng X, Lv J, Liao S, Ou Sh, and Shen Y. (2017) Purification and Structural Characterization of a Novel Water-Soluble Neutral Polysaccharide from Cantharellus cibarius and Its Immunostimulating Activity in RAW264.7 Cells. International Journal of Polymer Science. (3074915): 9.https://doi.org/10.1155/2017/3074915
4. Sharma A, Sharma A, and Tripathi A. (2021) Biological activities of Pleurotus spp. polysaccharides: A review. Journal of Food Biochemical 00:e13748. https://doi.org/10.1111/jfbc.13748
5. Neun BW, Cedrone E, Potter TM, Crist RM, and Dobrovolskaia MA. (2020) Detection of Beta-Glucan Contamination in Nanotechnology-Based Formulations. Molecules 25: 3367. https://doi:10.3390/molecules25153367
6. Schulze C, Stamer LLM, Huss SK, Schaufler K, Guenther S, and Schultze N. (2021) Establishment of a quantification method for β-glucans and their immune activity potential for quality control of β-glucan containing products. Carbohydrate Research 504: 108327. https://doi.org/10.1016/j.carres.2021.108327
7. Lam K-L, Cheung P, and Ch-K. (2013) Nondigestible long chain beta-glucans as novel prebiotics (Review). Bioactive Carbohydrates and Dietary Fibre. http://dx.doi.org/10.1016/j.bcdf.2013.09.001
8. Gibson GR, and Roberfroid MB. (1995) Dietary modulation of the human colonic microbiota. Introducing the concept of prebiotics. Journal of Nutrition 125: 1401–1412. https://doi.org/10.1093/jn/125.6.1401
9. Marquez-Riquel M and Joelmy Z. (2021) La espectroscopía Ifrarroja como herrmienta para identificar la degradación del polímero Polietilentereftalato – Bagazo de Caña. Revista QuímicaViva 20(3) ISSN1666-7948.
10. Morris HJ, Llauradó G, Beltrán Y, Bermúdez RC, García N, and Lebeque Y. (2020) Biotecnología de hongos comestibles: fuente de alimentos funcionales/nutracéuticos en sistemas agroalimentarios sostenibles de origen microbiano. Revista Congreso Universidad 9(3). ISSN: 2306-918X.
11. Bermúdez RC, García N, Gross P, and Serrano M. (2001) Cultivation of Pleurotus and agricultural substrates in Cuba. Micología Aplicada Internacional 13(1): 25-29. ISSN: 1534-2581.
12. Lebeque-Pérez Y, Fong-Lores O, Rodríguez-Leblanch E, Llauradó-Maury G, and Serrat-Díaz MJ. (2022) Evaluación in vivo de la pirogenicidad de bioproductos fúngicos con potencial prebiótico. Revista Información Científica 101(3): e3791. http://www.revinfcientifica.sld.cu/index.php/ric/article/view/3791
13. Llauradó G, Morris HJ, Heykers A, Lanckacker E, Cappoen D, Delputte P, Vanden-Berghe W, Salgueiro Z, and Cos P. (2021) Differential Induction Pattern Towards Classically Activated Macrophages in Response to an Immunomodulatory Extract from Pleurotus ostreatus Mycelium. Journal of Fungi 7:206. https://doi.org/10.3390/jof7030206
14. Lebeque Y, Morris HJ, Beltrán Y, Llauradó G, Gaime-Perraud I, Meneses M, Moukha S, Bermúdez RC, and García N. (2018) Proximal Composition, Nutraceutical Properties, and Acute Toxicity Study of Culinary-Medicinal Oyster Mushroom Powder, Pleurotus ostreatus (Agaricomycetes). International Journal of Medicinal Mushrooms. 20(12): 1185-1195. https://doi.org/10.1615/intjmedmushrooms.v20.i12.60
15. Omolara A. (2018) Computational modelling Procedures for Geometry Optimization, Kinetic and Thermodynamic Calculations using Spartan Software. A Review. Archives of Organic and Inorganic Chemical Sciences. 1(5): 122-125. http://doi.org/10.32474/AOICS.2018.01.000123
16. Pretsch E, Seibl J, and Simon W. (1998) Tablas para la determinación estructural por Métodos Espectroscópicos. Ed. Española. Barcelona: Springer-Verlag Ibérica.
17. Morris HJ, Beltrán Y, Llauradó G, Batista PL, Perraud-Gaime I, García N, Moukha S, Bermúdez RC, Cos P, Hernández E, and Diez JC. (2017) Mycelia from Pleurotus sp. (oyster mushroom): a new wave of antimicrobials, anticancer and antioxidant bio-ingredients. International Journal of Phytocosmetics and Natural Ingredients 2: 14. https://10.15171/ijpni.2017.14
18. Golak-Siwulska I, Kałużewicz A, Spiżewski T, Siwulski M, and Sobieralski K. (2018) Bioactive compounds and medicinal properties of Oyster mushrooms (Pleurotus sp.) Folia Horticulturae 30(2):191-201. https://10.2478/fhort-2018-0012
19. Gonzaga LM, Menezes TMF, De Souza JRR, Ricardo NMPS, and Soares de A S. (2013) Structural characterization of β-glucans isolated from Agaricus blazei Murill using NMR and FTIR spectroscopy. Bioactive Carbohydrates and Dietary Fibre. 2(2): 152-156. https://doi.org/10.1016/j.bcdf.2013.10.005
20. Yang K, Zhang Y, Cai M, Guan R, Neng J, Pib X and Sun P. (2020) In vitro prebiotic activities of oligosaccharides from the by-products in Ganoderma lucidum spore polysaccharide extraction. RSC Advances 10: 14794. https://doi.org/10.1039/c9ra10798c[21] Nie SH, Cui SW, and Xie M. (2018) “Beta-Glucans and Their Derivatives”. En: Nie S. Bioactive Polysaccharides. Elsevier Academic Press p. 99-141. http://dx.doi.org/10.1016/B978-0-12-809418-1.00003-4
22. Beltrán-Delgado Y, Morris-Quevedo HJ, Llauradó-Maury G, Bermúdez-Savón RC, and García-Oduardo N. (2020) Procedimientos para la producción de setas del género Pleurotus con potencial aplicación farmacológica. Revista Cubana de Química 32(2): 245-261. e-ISSN: 2224-5421
|
Revista QuímicaViva Número 2, año 22, Agosto 2023 quimicaviva@qb.fcen.uba.ar |